Efecto espasmolítico de Eugenol en tejido muscular uterino aislado de rata
Spasmolytic effect of Eugenol on isolated rat uterine smooth muscle
Resumen
Introducción. La dismenorrea primaria es el dolor asociado a la menstruación; es una patología de alta prevalencia cuya patogenia incluye la liberación de mediadores inflamatorios y espasmos del tejido uterino. Los anti-inflamatorios no esteroideos, principal tratamiento para esta patología, pueden ocasionar reacciones adversas y/o falla terapéutica. Por esta razón, el uso de terapias alternativas (extractos botánicos) es importante. El eugenol es un fenol aromático que ha demostrado tener propiedades, anestésicas, analgésicas, y anti-inflamatorias. Objetivo. Estudiar el efecto espasmolítico y mecanismo de acción del eugenol en útero aislado de ratas. Material y métodos. El efecto espasmolítico fue evaluado midiendo la relajación en tiras de útero aislado. Se determinó la respuesta a calcio con diferentes concentraciones de eugenol, y su efecto en combinación con distintos inhibidores para determinar el mecanismo de acción. Resultados. Eugenol causó un efecto espasmolítico dependiente de la concentración y la relajación no fue revertida por el bloqueo de receptores ß-adrenérgicos, sintasa de óxido nítrico, receptores a histamina y canales de potasio sensibles a ATP. Conclusiones. Eugenol produce un efecto espasmolítico por bloqueo de canales de calcio tipo L.
Palabras clave: Canales de Calcio, Dismenorrea, Espasmo, Relajación, Útero.
Abstract
Introduction: Primary dysmenorrhea is the pain associated to menstruation, is a high-prevalence pathology whose pathogenesis includes the release of inflammatory mediators and spasms of the uterine tissue. The non-steroidal anti-inflammatory drugs, the main treatment for this pathology, can cause adverse reactions and/or therapeutic failure; for this reason the use of alternative therapies (botanic extracts) is important. Eugenol is an aromatic phenol that has been shown to have properties, anesthetic, analgesic, and anti-inflammatory. Objective: To study the spasmolytic effect and mechanism action of eugenol in uterus of rats. Material and methods: The spasmolytic effect was assessed by measuring relaxation in strips of isolated uterus. We studied the response to calcium with different concentrations of eugenol, and its effect in combination with different inhibitors to determine the mechanism of action. Results: Eugenol caused a concentration-dependent spasmolytic effect and the relaxation was not reversed by the blockade of the ß-adrenergic receptor, nitric oxide synthase, histamine receptor, and potassium channel sensitive to ATP. Conclusions: The eugenol produced a spasmolytic effect by blocking calcium channels type L.
Keywords: Calcium channels, Dysmenorrhea, Spasm, Relaxation, Uterus.
Introducción
Dismenorrea
La dismenorrea se define como el conjunto de síntomas que aparecen al final del ciclo menstrual y que la persona asocia al comienzo de la menstruación e inclusive durante la misma. La dismenorrea es uno de los cuadros cíclicos, dentro de los procesos dolorosos pélvicos crónicos (1–3). En la actualidad el término se usa para referirse a todas aquellas sensaciones de malestar y dolor que se producen durante la menstruación (1).
La dismenorrea se clasifica en primaria cuando no está asociada a otras patologías pélvicas subyacentes (3,4) y en secundaria cuando el dolor que acompaña a la menstruación está asociado a la presencia de una anormalidad o patología pélvica (endometriosis, enfermedad pélvica inflamatoria, miomas, etc.) (3). También se puede clasificar de acuerdo a su severidad en: a) leve: cuando hay síntomas relacionados, no requiere medicación; b) moderada: puede o no requerir medicación, se acompaña de síntomas y puede ocasionalmente perturbar las actividades cotidianas; y c) grave o severa: se acompaña de síntomas severos e incapacitantes y son causas de ausentismo escolar y laborar y siempre es requerida la medicación (5,6).
La prevalencia de dismenorrea primaria oscila desde 16% hasta 93% a nivel mundial (2). En México, diversos estudios han reportado una prevalencia que va desde 28 a 90% (7–9). En Hidalgo se ha reportado en 2009 una prevalencia de 48.4%, y en 2010 en del 64% (5,6).
En la etiopatogenia de la dismenorrea primaria la explicación más aceptable es la producción en exceso de prostaglandinas (PGs) que provienen del endometrio secretor. El ácido araquidónico se deriva de los fosfolípidos por la enzima fosfolipasa lisosomal A2; la actividad lisosomal es entre otros factores regulada por los niveles de progesterona (10,11). Es debido a esto que cuando hay disminución de la progesterona en la fase lútea tardía del ciclo menstrual se elimina el efecto estabilizador en los lisosomas, el flujo menstrual, y la hidrólisis de los fosfolípidos para metabolizar ácido araquidónico. Como consecuencia, la disponibilidad permanente de ácido araquidónico como sustrato hace que sea metabolizado ya sea por ciclo-oxigenasa (COX) y/o por lipooxigenasa (LOX). Con lo anterior, junto con el trauma en el tejido durante la menstruación, se estimula la sobre producción de leucotrienos, tromboxanos y prostaglandinas, en especial PGF-2a (principal PG en la dismenorrea), que es responsable de la hipercontractilidad del miometrio, lo que conduce a la isquemia, la hipoxia del músculo uterino, y finalmente en dolor en las pacientes (1,11,12).<´p>
Anti-inflamatorios no esteroideos (AINEs) y combinación de fármacos como primer tratamiento
Para el tratamiento de la dismenorrea, como primera línea, se encuentran los anti-inflamatorios no esteroideos (AINEs). Éstos son un grupo de fármacos analgésicos no narcóticos, químicamente diferentes, que en general producen tres efectos: analgesia, anti-inflamación y antipiresis. El mecanismo de acción de los AINEs se basa en la inhibición de la enzima COX de la que se conocen 2 isoformas (COX-1 y COX-2), con una consecuente disminución de las prostaglandinas (PGs) que son las encargadas de modular la respuesta inflamatoria y el dolor (13). Los AINEs más utilizados en dismenorrea primaria son el ibuprofeno, diclofenaco, naproxeno, ácido mefánico, entre otros. Otros tratamientos utilizados son los medicamentos compuestos de varios fármacos como Buscapina Compositum® o Syncol® (14,15). Una meta-análisis donde se evalúa la eficacia de los AINEs en el tratamiento de la dismenorrea primaria se encontró que aunque tienen una mayor eficacia frente al placebo, presentan en mayor porcentaje efectos adversos gastrointestinales y neurológicos (6). Otros estudios también han encontrado falla terapéutica en AINEs y medicamentos compuestos (5,6).
Principales terapias alternativasAlgunas terapias alternativas para la dismenorrea primaria son los “suplementos dietéticos” que pueden ser derivados botánicos, vitaminas, minerales, enzimas y aminoácidos (2). Un meta-análisis evaluó la eficacia y la seguridad de diferentes suplementos dietéticos para el tratamiento de la dismenorrea, en el cual se encontró que no producen efectos secundarios e incluso poseen un efecto protector, sin embargo no existe suficiente evidencia de su eficacia (16).
Eugenol
El eugenol es un aceite de color amarillento y con un olor intenso, es comúnmente extraído del alabastrum seco de la Eugenia caryphillate, está implicado en el tratamiento de varios desordenes, especialmente los involucrados con el dolor y la inflamación (17,18). Hablando de la actividad analgésica y la capacidad anti-inflamatoria del eugenol, éstos efectos son producidos por la inhibición de COX-2, sin inhibición de la COX-1 (19). El eugenol, como un miembro de los compuestos fenólicos puede inhibir significativamente a la enzima 5-lipoxigenasa que es clave en la biosíntesis de leucotrienos y que, por lo tanto, puede reducir la producción de mediadores inflamatorios (19). Estas características perfilan al eugenol como un agente a utilizarse en la terapia alternativa, por lo que el objetivo de este estudio fue evaluar el efecto espasmolítico y el mecanismo de acción del eugenol en tejido uterino asilado de ratas Wistar.
Material y métodos
Fármacos utilizados
Se utilizaron los siguientes compuestos: Sal sódica de diclofenaco, eugenol ReagentPlus® 99%, ß-Estradiol 3-benzoate =97%, dimetil sulfoxido =99.9% (DMSO), cimetidina, NG-Nitro-L-Arginina (L-NAME), glibenclamida y clorhidrato de propanolol. Todos los fármacos se obtubieron de la empresa Sigma-Aldrich™. El eugenol y la glibenclamida se disolvieron en DMSO. El diclofenaco, cimetidina, L-NAME y propanolol fueron disueltos en agua bidestilada. El ß-Estradiol 3-benzoate se diluyó en aceite de maíz.
Animales de experimentación
Se utilizaron 40 ratas hembras de la línea albina Wistar, de peso entre 200 a 220 g del bioterio del Centro de Investigación del cuerpo académico de Biología de la Reproducción. Los animales estuvieron en ciclos de luz/obscuridad de 12/12 horas y tuvieron libre acceso a alimento y agua.
Sistema de registro isométrico para medir la contracción del tejido uterino aislado de la rata.
Se realizó eutanasia de la rata en una cámara de CO2. Se efectúo un corte en pared abdominal y se extrajo el útero de rata. De cada cuerno uterino aislado se obtuvieron 6 tiras uterinas, las cuales se colocaron en el sistema de registro isométrico para tejidos aislados, en 3 mL de solución Ringer, a 37°C, pH 7.4 y burbujeadas durante todo el experimento con gas carbógeno. Los tejidos se estimularon electromecánicamente con KCl (60 mM) induciendo la contracción tónica sostenida, sobre las que se estudió el efecto del eugenol a diferentes concentraciones (µM).
Evaluación del mecanismo de la acción relajante del eugenol
Se evaluó la respuesta al calcio extracelular en el tejido uterino montado en el sistema de registro isométrico. Primero se realizó la estimulación con una solución despolarizante de KCl (60 mM) sin Ca2+, sobre la que se incubaron diferentes concentraciones de eugenol por 15 minutos. Posteriormente se adicionó calcio 1 mM y se registró el porcentaje de contracción.
También se trabajó la incubación (15 minutos) sobre la contracción tónica sostenida de diferentes fármacos inhibidores: cimetidina (10 µM) (antagonista de los receptores H2), L-NAME (100 µM) (inhibidor de la síntesis de óxido nítrico), propranolol (10 µM) (antagonista ß-adrenérgico) y glibenclamide (10 µM) (bloqueador de los canales de potasio sensibles a ATP); seguido a esto se adicionó eugenol a la concentración de 230 µM y se estudió el porcentaje de relajación.
Análisis estadístico
Los datos se analizaron por un análisis de varianza (ANOVA), seguido de una prueba de comparación múltiple Newman-Keuls con el programa SigmaPlot. Se consideraron valores estadísticamente significativos aquellos que presentaron una p<0.05. Utilizando regresión wizard en el programa SigmaPlot se obtuvo la concentración inhibitoria 50 (CI50) y la respuesta máxima (Rmax).
Resultados
En el sistema de registro isométrico para tejido aislado, el eugenol demostró inhibir de manera estadísticamente significativa (p<0.05) las contracciones tónica sostenida por estímulo electromecánico (efecto relajante). Con estos datos se obtuvieron la concentración inhibitoria 50 (CI50) y la respuesta máxima (Rmax) (Figura 1 y 2).
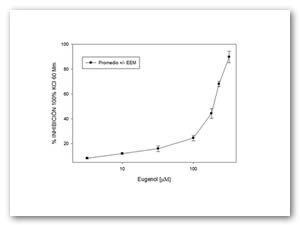
Figura 1. Efecto de diferentes concentraciones de eugenol sobre un estímulo electromecánico de KCl 60 mM. Cada punto representa el valor promedio de 8 experimentos (n=9) y las barras verticales representan el valor del error estándar de la media (EEM).
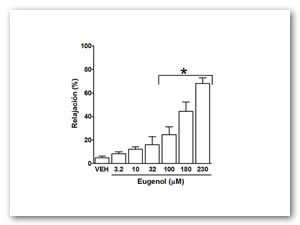
Figura 2. Efecto relajante (%) de eugenol sobre un estímulo electromecánico de KCl 60 mM. Cada punto representa el valor promedio de 8 experimentos (n=8) y las barras verticales representan el valor del error estándar de la media (EEM). * p<0.05
Para comprobar que el efecto de eugenol es dependiente del calcio, se estudió la respuesta de diferentes concentraciones de eugenol al estímulo de 1mM de Ca2+ donde nuevamente se registró el porcentaje de inhibición de la contracción (Figura 3). Posteriormente la curva fue comparada con el mismo experimento pero utilizando nifedipina (inhibidor específico de canales de calcio tipo L), con los resultados obtenidos se observa una importante similitud (Figura 4).
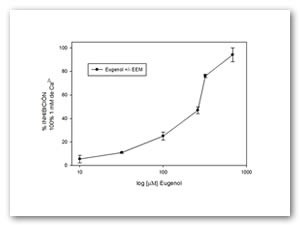
Figura 3. Efecto de eugenol sobre el estímulo de 1 mM de Ca2+ sobre tiras de útero aislado de rata estrogenizada. Cada punto representa el valor promedio de 9 experimentos (n=9) y las barras verticales representan el valor del error estándar de la media (EEM).
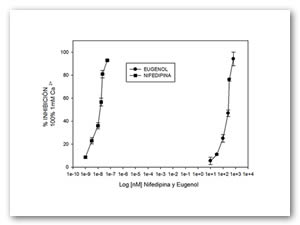
Figura 4. Curva comparativa entre el efecto inhibidor del eugenol comparado con nifedipina sobre el estímulo de 1 mM de Ca2+ en tiras de útero aislado de rata estrogenizada. Cada punto representa el valor promedio de 9 experimentos (n=9) y las barras verticales representan el valor del error estándar de la media (EEM).
Para investigar el probable mecanismo de acción del efecto relajante del eugenol, se realizaron experimentos en donde se estudió el efecto relajante de eugenol en combinación con diferentes fármacos: cimetidina, L-NAME, propranolol y glibenclamide. El efecto relajante de eugenol a la concentración de 230 µM no presentó cambios estadísticamente significativos en presencia de los diferentes inhibidores (p>0.05) (Figuras 5 y 6).

Figura 5. Trazos mostrando los efectos de contracción (KCl) y el efecto del eugenol (320 µM) sobre tejidos preincubados con propranolol, L-NAME, cimetidina y glibenclamida.
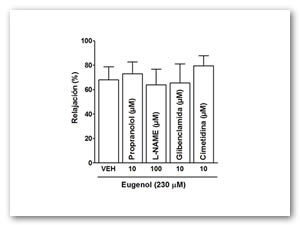
Figura 6. Efecto de los diferentes inhibidores sobre el efecto relajante de la concentración de 230 µM de eugenol. Cada punto representa el valor promedio de 5-9 experimentos y las barras verticales representan el valor del error estándar de la media (EEM).
Discusión
Los presentes resultados muestran que el eugenol tuvo un efecto espasmolítico concentración-dependiente sobre las contracciones tónicas sostenidas inducidas por una solución despolarizante de KCl 60 mM. El efecto relajante del eugenol fue revertido completamente, esto se demostró al recuperarse el tejido después de varios lavados, y a responder nuevamente al estímulo de KCL 60 mM. Estos resultados demuestran que su capacidad es reversible, sugiriendo que en su mecanismo de acción relajante, no incluye su unión con un enlace covalente a algún receptor y/o canal ionico.
Se sabe que el estímulo de KCl 60 mM actúa mediante la despolarización de la membrana celular y la apertura de los canales de Ca2+ y aumento la [Ca2+]i que es el principal responsable de la contracción miometrial (participante en el dolor menstrual), por lo tanto el bloqueo de dichos canales iónicos produce un efecto espasmolítico. En nuestro estudio, la incubación de diferentes concentraciones de eugenol y el posterior estímulo de Ca2+ 1 mM demostró que era capaz de disminuir la entrada de Ca2+ por el bloqueo parcial de canales de Ca2+. Estos hallazgos concuerdan con un estudió (20), en donde el eugenol demostró inhibir canales de calcio. Sin embargo, el estudio mencionado anteriormente se realizó en cultivos celulares con canales tipo T. Por otro lado, en otra investigación se demostró la inhibición de canales de calcio dependientes del voltaje en células de músculo liso por parte del eugenol (21). Es importante señalar que en el estudio anterior se trabajó sobre arterias cerebrales de rata.
En nuestro estudio, los resultado se compararon con los obtenidos al ensayar nifedipina y se encontró una similitud. Sin embargo, las concentraciones efectivas de la nifedipina se encuentran dos órdenes de magnitud por debajo del eugenol, esto es debido a que es un bloqueador específico de los canales de calcio tipo L (los más abundantes en el músculo liso y cardiaco)(22).
Los ensayos en combinación con los diferentes bloqueadores mostraron que el efecto relajante del eugenol no fue afectado significativamente por el propranolol un bloqueador de receptores ß2 adrenérgicos, lo que demuestra que el efecto espasmolítico no se realiza a través de la activación de los adrenoceptores ß. De igual forma el L-NAME, un inhibidor de la sintasa del óxido nítrico, no modificó de manera significativa el efecto relajante del eugenol, señalando que el óxido nítrico no está involucrado en su acción relajante. La cimetidina, un inhibidor de los receptores a histamina H2 no afectó significativamente la relajación del eugenol, lo que permite excluir a estos receptores de su participación en el mecanismo de acción. Por último la glibenclamida, un bloqueador de canales de potasio sensible a ATP, tampoco antagonizó los efectos inhibidores del eugenol, lo que indica que sus actividades relajantes no se deben a la apertura de los canales de potasio sensibles a ATP. Aunque se necesitan más estudios, estos datos sugieren que el eugenol actúa mediante el bloqueo de canales de calcio dentro de la célula del músculo liso uterino, inhibiendo la contracción y resultando en un efecto relajante.
Un estudio realizado por Bennett et al (23) donde evaluaron el efecto del eugenol en diferentes tejidos aislados, tales como el intestino de rata, miometrio humano y útero de rata; encontraron que el eugenol reducía la contracción de los tejidos. Los autores propusieron que dicho efecto se debió a la inhibición de la COX y la consecuente inhibición de la síntesis de PGs causantes de la contracción. Aunque existe evidencia de demuestra que eugenol causa la inhibición de COX-2, sin inhibición de la COX-1 (19). No obstante, los autores (23) no presentan ninguna evidencia experimental para soportar la propuesta de la inhibición de COX en tejido aislado. En este sentido, se requiere realizar más experimentos para demostrar el papel de COX en los efectos relajantes de eugenol en tejido muscular liso aislado.
Conclusión
Los resultados de esta investigación describen no sólo el efecto del eugenol sobre el útero de rata, también ofrecen un posible mecanismo de acción en este tipo de tejido en particular. Se encontró que el eugenol tiene un efecto espasmolítico concentración-dependiente es decir a mayor concentración mayor efecto. Los resultados del experimento dependiente de calcio, su comparación con nifedipina y la combinación de los diferentes bloqueadores sugieren que el mecanismo de acción del eugenol se debe al bloqueo de canales de calcio tipo L, ya que no se alteró la inhibición de la dosis a probar.
Referencias
1Latthe PM, Champaneria R, Khan KS. Dysmenorrhoea. BMJ Clin Evid. 2011;2:1–59.
2Midilli TS, Yasar E, Baysal E. Dysmenorrhea characteristics of female Students of health school and affecting factors and their knowledge and use of complementary and alternative medicine methods. Holist Nurs Pract. 2015;29(4):194–204.
3García B, Chillón R, Rebollo J, Orta MA. Dismenorrea primaria y fisioterapia. Fisioterapia. 2005;27(6):327–42.
4Yu A. Complementary and alternative treatments for primary dysmenorrhea in adolescents. Nurse Pract. 2014;39(11):1–12.
5Ortiz MI. Primary dysmenorrhea among Mexican university students: Prevalence, impact and treatment. Eur J Obstet Gynecol Reprod Biol. 2010;152(1):73–7.
6Ortiz MI, Rangel-Flores E, Carrillo-Alarcón LC, Veras-Godoy H a. Prevalence and impact of primary dysmenorrhea among Mexican high school students. Int J Gynaecol Obstet. 2009;107(3):240–3.
7Pedrón-Nuevo N, González-Unzaga LN, De Celis-Carrillo R, Reynoso-Isla M de la T. Frequency of dysmenorrhea and associated symptons in women of 12 to 24 years of age. Ginecol Obs Mex. 1998;66:492–4.
8Pawlowski B. Prevalence of menstrual pain in relation to the reproductive life history of women from the Mayan rural community. Annals of human biology. 2004;3(1):1–8.
9Velasco R, Mora A, González L, Bonilla O. Características clínica y tratamiento de dismenorrea en estudiantes de licenciatura en enfermería. Medigraphic. 2006;14(1):29–34.
10Mrugacz G, Grygoruk C, Sieczynski P, Grusza M, Bolkun I, Pietrewicz P. Etiopathogenesis of Dysmenorrhea.Clinical Expert Series. 2013;17(1):85–59.
11Yusoff M. Dysmenorrhea and prostaglandins. Gynecol Endocrinol New York. 1987;405–21.
12Morrow C, Naumburg EH. Dysmenorrhea. Prim Care - Clin Off Pract. 2009;36(1):19–32.
13Kawabata A. Prostaglandin E2 and pain--an update. Biol Pharm Bull. 2011;34:1170–664.
14Marjoribanks J, Ayeleke RO, Farquhar C, Proctor M. Nonsteroidal anti-inflammatory drugs for dysmenorrhoea. Cochrane database Syst Rev. 2015;(7):CD001751.
15Iacovides S, Avidon I, Baker FC. What we know about primary dysmenorrhea today: A critical review. Hum Reprod Update. 2015;21(6):762–78.
16Pattanittum P, Kunyanone N, Brown J, Us S, Barnes J, Seyfoddin V. Dietary supplements for dysmenorrhoea ( Review ). 2016;(3).
17Tragoolpua Y, Jatisatienr A. Anti-herpes simplex virus activities of Eugenia caryophyllus (Spreng). Phytother Res. 2007;21:1153–8.
18González R. Eugenol: propiedades farmacológicas y toxicológicas. Ventajas y desventajas de su uso. Rev Cuba Estomatol. 2002;39(2).
19Satya N, Raghavendra R, Lokesh BR, Akhilender K. Spice phenolics inhibit human PMNL 5-lipoxygenase. Prostaglandins Leukot Essent Fat Acids. 2004;70(6):521–8.
20Seo H, Li HY, Perez-Reyes E, Lee J. Effects of eugenol on type Ca2 channel isoforms. The journal of pharmacology and experimental therapeutics. 2013;347:310-7.
21Peixoto-Neves D, Leal-Cardoso J, Jaggar J. Eugenol dilates rat cerebral arteries by inhibiting smooth muscle cell voltage-dependent calcium channels. J Cardiovasc Pharmacol. 2014:64(5):401-406.
22Gáspár R, Hajagos-tóth J. Calcium Channel Blockers as Tocolytics?: Principles of Their Actions , Adverse Effects and Therapeutic Combinations. Pharmaceuticals. 2013;6:689–99.
23Bennett A, Stamford IF, Tavares IA, Jacobs S. The Biological Activity of Eugenol , a Major Constituent of Nutmeg ( Myristica fiagrans ): Studies on Prostaglandins , the Intestine and other Tissues. Phmotherapy Research. 1988;2(3):124–30.
[a] Centro de Investigación de Biología de la Reproducción, Área Académica de Medicina del Instituto de Ciencias de la Salud de la Universidad Autónoma del Estado de Hidalgo. Correo: marjk6@hotmail.com
[b] Centro de Investigación de Biología de la Reproducción, Área Académica de Medicina del Instituto de Ciencias de la Salud de la Universidad Autónoma del Estado de Hidalgo.