Asignatura: Farmacocinética Básica y Farmacocinética Clínica
El conocimiento de los modelos compartimentales lineales y de los sistemas no lineales en la enseñanza de la Farmacocinética es fundamental en los alumnos de sexto y séptimo semestre que cursan las materias de Farmacocinética Básica y Farmacocinética Clínica respectivamente. Por tal razón el ingreso del fármaco al organismo representado experimentalmente mediante una simulación in vitro del modelo abierto de un compartimiento para el fármaco Gentamicina ilustra claramente la entrada y salida del fármaco en el organismo siguiendo una cinética de eliminación de primer orden, lo cual es importante para que el alumno comprenda la importancia de interpretar los datos obtenidos del monitoreo de fármacos y que sea capaz explicar matemáticamente mediante la obtención de parámetros farmacocinéticos el comportamiento del fármaco en el organismo.
Palabras clave: Simulación, Farmacocinética, Gentamicina.
The knowledge of compartmental models of linear and nonlinear systems in the teaching of pharmacokinetics is essential to the sixth and seventh semester´s students who attend to Basic and Clinical Pharmacokinetics respectively. The drug Gentamicin clearly ilustrate the entry of drug to the body shown experimentally by in vitro simulation model of a compartment open. The drug Gentamicin shows the input and output of the drug in the body following a first order kinetic elimination, which is important to students understand the importance of interpreting the data obtained from the monitoring of drugs and explain the pharmacokinetics parameters obtained with mathematic calculation of drug behavior in the body.
Keywords: Simulation, Pharmacokinetic, Gentamicin.
La Gentamicina es un antibiótico antimicrobiano del grupo de los aminoglucósidos, tiene acción sobre bacterias Gram-positivos y Gram-negativos.
Se utiliza en el tratamiento de sepsis neonatal, septicemia, infecciones del sistema nervioso central (SNC), infecciones urinarias, respiratorias, gastrointestinales, y en infecciones en huesos, piel y de tejidos blandos.
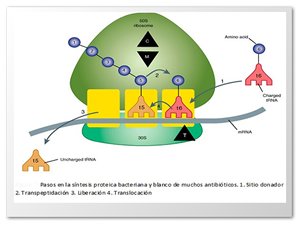
MECANISMO DE ACCIÓN: Es un antibiótico bactericida que actúa a nivel de ribosomas alcanzando el citoplasma bacteriano para poder ejercer su acción. Atraviesa la membrana externa mediante porinas por un proceso pasivo y se difunde a través de la membrana celular en contra de un gradiente de concentración, logrando grandes concentraciones del antibiótico en el citoplasma. A nivel ribosomal se une a la unidad 30s en las proteínas s12, s3, s4 y s5 y bloquea el inicio de la síntesis proteica al fijar el complejo 30s-50s al codón de inicio del RNA mensajero. En la Figura 1 se ilustra el mecanismo de acción de los algunos antibióticos como la gentamicina.
Figura 1. Mecanismo de acción de los amino glucósidos (Velázquez, 2008).
Absorción: Administrada por vía oral su biodisponibilidad es baja, por vía intramuscular se absorbe rápidamente y por vía endovenosa se debe controlar su administración para no provocar bloqueo neuromuscular. Atraviesa la placenta y la endolinfa, y parcialmente la barrera hematoencefálica.
Distribución: Se biodistribuye en el líquido extracelular; la redistribución inicial a tejidos es del 5 al 15 % con acumulación en las células de la corteza renal; también atraviesa la placenta. En la orina aparecen altas concentraciones, pero en las secreciones bronquiales, líquido cefalorraquídeo, bilis, espacio subaracnoideo, tejido ocular, humor acuoso, la concentración es escasa.
Metabolismo: no se metaboliza.
Excreción: es ampliamente excretado en forma inalterada por filtración glomerular manifestando altas concentraciones en orina. Administrado por dosis única del 53 al 98% se excreta por la orina en 24 horas. Sin embargo, cuando existe un problema en la función renal, la acumulación del fármaco da lugar a la toxicidad si no se realiza un ajuste de dosis.
Tiempo de vida media: se prolonga en recién nacidos porque el sistema renal inmaduro es incapaz de excretar este fármaco rápidamente; durante los primeros días de vida el tiempo de vida media puede aumentar de 5 a 6 horas. También en el anciano se evidencia una vida media prolongada. En pacientes con quemaduras graves la vida media puede estar significativamente disminuida y en condiciones de función renal normal se reporta un tiempo de vida media de 4 h (1).
Se excreta por filtración glomerular.
Hipersensibilidad, Nefrotoxicidad, Neurotoxicidad, Ototoxicidad, Parestesias, Tetania, Signo positivo de Chvostek y Trousseau, Síndrome de Fanconi, Hepatomegalia, Esplenomegalia, Síndrome de miastenia gravis, Alteraciones hematológicas (2).
La dosis y la vía de administración se establecen según sea la gravedad de la infección, la sensibilidad de la bacteria, edad, peso y estado general del paciente.
Adultos: la dosis recomendada para pacientes con infecciones graves y función renal normal es de 3 mg/kg/día administrados en 3 dosis iguales cada 8 horas. En pacientes con infecciones que amenacen la vida, las dosis administradas son 5 mg/kg/día que pueden administrarse en tres o cuatro dosis iguales. Estas dosis deberán ser disminuidas a 3 mg/kg/día, tan pronto como la respuesta clínica lo disponga.
Niños: En niños menores de 5 años de edad es recomendable una dosis de 7,5 mg/kg de peso/24 horas. En niños de 5 a 10 años de edad se recomienda una dosis de 6 mg/kg de peso/24 horas. En ambos casos, la dosificación se administra dividida en tres dosis. En recién nacidos de una semana de vida y en prematuros la dosificación recomendada es de 5 mg/kg de peso/24 horas, divididos en dos dosis. En todos los demás lactantes, la dosificación es similar a la recomendada para niños menores de 5 años de edad: 7,5 mg/kg de peso/24 horas divididos en tres dosis.
La duración del tratamiento de todos los pacientes es de 7 a 10 días. En infecciones graves y complicadas puede ser necesario un curso de terapia más prolongado. En tales casos es recomendable hacer un control de las funciones renales, auditivas y vestibulares debido a que las manifestaciones de toxicidad son más frecuentes cuando los tratamientos son mayores de 10 días. La dosis debe disminuirse si está clínicamente indicado. La administración endovenosa de Gentamicina puede ser particularmente benéfica para el tratamiento de pacientes con septicemia bacteriana o aquellos que se encuentren en estado de shock. También puede ser la vía de preferencia para algunos pacientes con insuficiencia cardíaca congestiva, alteraciones hematológicas, quemaduras graves o en aquellos con reducción de las masas musculares. La Gentamicina no debe administrarse por vía intravenosa sin haberse diluido previamente. Para administración intravenosa en adultos una simple dosis de Gentamicina puede ser diluida de 50 a 200 mL de solución de cloruro de sodio 0,9 % estéril o en solución estéril de dextrosa al 5 % (sin exceder la concentración de 1 mg/mL); en niños el volumen del diluente dependerá de las necesidades de líquido del paciente. La solución debe ser infundida en un período de media hora a dos horas. Las dosis recomendadas para administración intramuscular e intravenosa son idénticas (3).
Sobredosificación: En el caso de sobredosis o de reacciones tóxicas, la hemodiálisis o diálisis peritoneal pueden ayudar en la depuración de la Gentamicina de la sangre. Estos procedimientos son de particular importancia en enfermos con insuficiencia renal.
Representar la simulación de un modelo abierto de un compartimiento, utilizando una dosis única del fármaco Gentamicina en agua.
| Material | ||
| Espectrofotómetro UV-visible | - | 1 |
| Celdas de cuarzo | - | 2 |
| Balanza analítica | - | 1 |
| Tubos de ensayo | 13 x 100 | 20 |
| Vasos de precipitados de vidrio | 50 ml | 5 |
| Vasos de precipitados de vidrio | 100 ml | 5 |
| Pipeta volumétricas | 3 ml | 4 |
| Matraz de vástago | 250 o de 500 ml | 1 |
| Vidrio de reloj | - | 1 |
| Espátula acanalada | - | 1 |
| Piseta | - | 1 |
| Gradilla | - | 1 |
| Probeta graduada | 250 ml | 1 |
| Reactivos | - | 50 mg |
| Agua destilada | - | - |
| Material por equipo | ||
| Botella de Mariotte | - | 1 |
| Espectrofotómetro UV-visible | - | 1 |
En la Figura 2 se muestra la representación del modelo abierto de un compartimiento administrado por bolo intravenoso. (MAUC i.v.).
Figura 2. Representación de la simulación del modelo abierto de un compartimiento por bolo i.v. de Gentamicina.
En la TABLA 1 se muestran los datos obtenidos a partir de una simulación del modelo abierto de un compartimiento (MAUC i.v.), dosis única utilizando el programa WinNonlin.
| t (h) | Cp (mg/ml) Datos Calculados |
Cp (mg/ml) Datos Ajustados* |
| 1 | 5.05 | 5.052 |
| 4 | 3.03 | 3.027 |
| 8 | 1.53 | 1.529 |
| 12 | 0.77 | 0.7721 |
| 16 | 0.39 | 0.39 |
| 20 | 0.19 | 0.197 |
| 24 | 0.1 | 9.95E-02 |
| 28 | 5.00E-02 | 5.03E-02 |
En la Figura 3 se muestra el perfil farmacocinético obtenido de la simulación in vitro del antibiótico Gentamicina.
Figura 3. Perfil farmacocinético obtenido de la simulación de Gentamicina in vitro.
En La TABLA 2 se muestran los parámetros farmacocinéticos obtenidos en la simulación de Gentamicina in vitro.
| TABLA 2. PARÁMETROS FARMACOCINÉTICOS DE GENTAMICINA |
|||
| Parámetro | Valor | Des.std | °CV |
| K10-HL(h-1) | 4.0592 | 0.0051 | 0.13 |
| Cp° (mg/mL) | 5.9924 | 0.0046 | 0.08 |
| Cl(mL/h) | 0.1710 | 0.0002 | 0.09 |
| AUMC(mg*h/ml)2 | 205.5133 | 0.4273 | 0.21 |
| MRT (h) | 5.8562 | 0.0075 | 0.13 |
| Vss (mL) | 1.0013 | 0.0008 | 0.08 |
A partir de las propiedades del fármaco Gentamicina, se pudo comprobar en la simulación farmacocinética del antibiótico, que este fármaco se caracteriza por presentar un margen terapéutico estrecho por lo que la posología se debe ajustar de forma personalizada y forma parte de los fármacos sujetos al monitoreo clínico, en este caso tras la administración de una dosis única se representó el comportamiento del fármaco en el organismo mediante la simulación in vitro del antibiótico en agua siguiendo un modelo abierto de un compartimento con eliminación de primer orden.
1. Velázquez L. Farmacología Básica y Clínica. 18 Ed. Madrid, España: Médica Panamericana, 2008: p 1099-1115.
2. Nakamagoe M, Tabuchini K, Nishimura B, Ha A. Effects of neuroactive steroids on cochelear hair cell death induced by gentamicin vs. National Library of Medicine. National Institute Health 2011; 1: 1443-1450.
3. Ausin V, Moreno Guillén S. Tratado de enfermedades infecciosas. En: Microbiología Clínica. 3 ed. España: Panamericana, 2006: p 108-275.
[a]Profesor Investigador de la Universidad Autónoma del Estado de Hidalgo <<