El objetivo de esta investigación fue optimizar las condiciones para la extracción por termoultrasonido de compuestos antioxidantes a partir de residuos de mango mediante un procesador de ultrasonidos de 1500W a una frecuencia constante de 20 kHz, la amplitud osciló entre 80-90% y tiempo de 5-15 min. Posteriormente se realizó la cuantificación de compuestos antioxidantes (fenoles totales 8837.68 mgEAG/100g bs, ácido ascórbico 5730.67 mgEAA/100g bs) y la actividad antioxidante (DPPH• 60080 µMET/100g bs, ABTS•+ 76618 µMET/100g bs). Los datos fueron analizados utilizando la metodología de superficie de respuesta (MSR) para las condiciones óptimas de extracción. Por último se realizó una comparación de las propiedades funcionales de los extractos sometidos a termoultrasonido con respecto a la extracción acuosa e hidroalcohólica de compuestos antioxidantes.
Los valores óptimos de las variables seleccionadas para la obtención de componentes antioxidantes fueron amplitud de 91% y tiempo 7 minutos. Cabe mencionar que la extracción por termoultrasonido demostró ser la mejor opción para la extracción de los componentes antioxidantes de los residuos de mango en comparación con los métodos convencionales, lo cual representaría una ventaja para la industria alimentaria, como alternativa sustentable en el aprovechamiento de los subproductos del mango.
Palabras clave: compuesto fenólicos, ácido ascórbico, ABTS•+, DPPH
The aim of this research was to optimize the conditions for obtaining a better yield antioxidant compounds from mango waste, a 1500 W ultrasonic processor was used for sonication, at a constant frequency of 20 kHz with amplitude that ranged from 80-90% and time 5-15 min. Later it was performed quantifying antioxidant compounds (total phenols 8837.68 mgGAE/100g db, ascorbic acid 5730.67 mg AAE/100g db), and the antioxidant activity (DPPH• 60080 µM TE/100g db, ABTS•+ 76618 µM ET/100g db). Data were analyzed using response surface methodology (MSR) for optimum extraction conditions. Finally a comparison of the functional properties of the extracts under thermo-ultrasound with respect to aqueous and hydroalcoholic extraction of antioxidant compounds was performed.
The optimal values of selected variables, for obtaining antioxidant components were 91% amplitude and time of 7 minutes. It is noteworthy that the thermoultrasound extraction proved the best option for extracting antioxidants components from waste of mango compared with conventional methods, which would represent an advantage for the food industry as a sustainable alternative to the use of sub-products of mango.
Keywords: phenolic compound, ascorbic acid, ABTS•+, DPPH•
El mango es una fruta de la familia de las Anacardiceae de genero Mangifera y especie M. indica L, es el fruto más utilizado para consumo fresco, después del plátano y los cítricos (Porras, 2011). Es una fruta de la zona intertropical, de pulpa carnosa y semiácida (Rodriguez, 2012), siendo de los frutos más importantes y populares, principalmente debido a su delicioso sabor y valor nutricional (Wang et al., 2010), es reconocido como un fruto con excelentes propiedades organolépticas, gracias a su contenido de azúcares, ácidos (málico, palmítico, p-cumárico y mirístico), vitamina C, aromas (fenoles) y pigmentos (carotenoides), además del contenido de fibra soluble, que lo hacen atractivo para todo tipo de consumidor (Quintero et al., 2013). Contiene una variedad de compuestos fenólicos como es el caso del ácido elágico y el ácido tánico, y uno que es específico para el mango la mangiferina, la cual ofrece varios beneficios a la salud (Sogi et al., 2012). Todos tienen en su estructura uno o más anillos aromáticos con al menos un sustituyente hidroxilo (Zou, T. et al., 2014). Su estructura química es propicia para secuestrar radicales libres, debido a la facilidad con la que el átomo de hidrógeno desde el grupo hidroxilo aromático puede ser donado a la especie radical, y a la estabilidad de la estructura quinona resultante que soporta un electrón desapareado (Ajila et al., 2007).
Los principales países donde hoy en día se cultiva es en la India, Indonesia, Florida, Hawai, México, Sudáfrica, Egipto, Israel, Brasil, Cuba, Filipinas, entre otros (Porras et al., 2011).
La cadena agroindustrial del mango en nuestro país está dirigida en dos terceras partes al sector primario o venta en fresco y una tercera parte al sector secundario o preparación y envasado de frutas, del cual el 80% se dirige a la producción de pulpas, jugos y néctares (Guzmán et al., 2012).
De acuerdo al estudio de la Cadena Agroalimentaria del Mango uno de los problemas más importantes de la transformación del mango es el mínimo desarrollo tecnológico para su industrialización, por lo que se privilegia su venta en fresco lo que implica que los productos finales tengan un bajo valor agregado en el mercado y existe un alto desperdicio de materia prima (Mejía et al., 2007), dependiendo de la variedad de mango, la cáscara puede constituir 15 a 18% del peso total del fruto y la semilla 13 a 29%, por lo que junto con la pulpa que queda adherida a estos, representa un importante volumen de desecho (Guzmán et al., 2010).
Las cáscaras y la semilla del mango que pueden considerarse desechos podrían ser una fuente importante de compuestos bioactivos, tales como la pectina, polifenoles y manguiferina en las cáscaras, ácidos grasos poliinsaturados en la semilla y compuestos de naturaleza fenólica con actividad antioxidante y antiinflamatoria. Además se ha reportado una importante actividad antimicrobiana en extractos de semilla de mango, debido a la naturaleza de los compuestos polifenólicos que contienen (Ajila et al., 2007; Engels et. al., 2009).
Se ha señalado que las cáscaras de diferentes variedades de mango contienen pectina de alta calidad, por su importante concentración en ácido galacturónico y su grado de esterificación (Sudhakar & Maini, 2000; Schieber et al., 2004) así como fibra dietaria con un excelente equilibrio entre fibra soluble e insoluble, por lo que puede ser un ingrediente en alimentos funcionales con actividad hipoglucemiante, hipocolesterolémico, e hipotrigliceridémico (Lurrauri et al., 1996).
En los últimos años se ha presentado un incremento en la utilización de residuos agroindustriales procedentes del mango (Guzmán et al., 2010; Mejía et al., 2007), ha aumentado el interés en la investigación, ya que se utiliza para la obtención de compuestos bioactivos, azúcares fermentables, aceite, entre otros (Ajila et al, 2007; Mejia, 2007; Sudhakar & Maini, 2000). Con la finalidad de aprovechar mayor cantidad de la fruta se han desarrollado diversas estrategias, una de ellas es la extracción de compuestos mediante tecnologías emergentes, como es el caso del ultrasonido (Zou, T. et al., 2014).
El ultrasonido es una onda de sonido inaudible por la frecuencia auditiva de los seres humanos, por encima de 16 kilohercios. Raylegh en 1917, pudo ver que la cavitación se puede producir por las ondas sonoras en un medio líquido. Las zonas de la causa de compresión y descompresión, si es lo suficientemente intenso, las cavidades de pequeño tamaño que pueden ligar a nivel local implosión a 5500°C. La energía de las vacuolas de cavitación se utiliza para causar la erosión de los sólidos, que se suspenden en el medio líquido. Las fibras vegetales son membranas disueltas, células rotas, partículas resistentes a la absorción que permiten una transferencia casi instantánea de compuestos de interés en el disolvente. La ecografía se utiliza para extraer el objetivo, con un solvente, una fracción molecular contenida en el material vegetal y animal. Posteriormente es requerida una etapa de filtración del extracto. (Estrada, 2012).
Hoy en día el ultrasonido de potencia se considera una prometedora tecnología para la industria de procesamiento de alimentos (Herrero et al., 2006), los usos benéficos del ultrasonido radican en el efecto físico, mecánico y químico que causan sobre el alimento facilitando fenómenos como el rompimiento celular, la desgasificación de líquidos, homogenización de emulsiones y la dispersión de materiales agregados entre otros (Fernández, 2008; Herrero et al.,2006).
El efecto de los ultrasonidos sobre los agentes alterantes de los alimentos es limitado y dependiente de múltiples factores por ello, su aplicación se ha encaminado hacia la combinación, simultanea o alterna, con otras técnicas (Chia, et al. 2014). La aplicación de ultrasonidos y tratamientos térmicos suaves (<100 ºC, habitualmente entre 50 - 60 ºC) ha dado lugar al procedimiento denominado termoultrasonicación. La combinación con incrementos de presión (< 600 MPa) se denomina manosonicación, mientras que las tres estrategias de forma conjunta se conocen como manotermosonicación (Dolores et al., 2006).
Para extracción mediante ultrasonido, se han desarrollaron varias técnicas, una de ellas consiste en la exposición del material a ondas acústicas de una frecuencia determinada (González et al., 2009), la utilización de ondas acústicas para la destrucción de la pared celular fue estudiada entre otros por Faerman et al. (2002), quienes demostraron experimentalmente que la aplicación de ultrasonido a baja frecuencia, causa una fuerte destrucción celular, incluso mayor que cuando se aplican ondas de alta frecuencia, por lo tanto el objetivo de este estudio fue la optimización de las condiciones de extracción por termoultrasonido de componentes antioxidantes como una estrategía emergente de aprovechamiento sustentable de los subproductos del despulpado del mango.
Los residuos industriales cáscara y semilla se obtuvieron después de realizar el despulpado del mango con un despulpador de planta piloto (Jersa 3009406 Mexico), para retirar las pulpa, se pasó a una maquina pulverizadora y a un molino de martillos (Veyco MPV 400 JUMBO Mexico) donde se obtuvo una pasta con los residuos, para su conservación se llevó a congelación, se almacenaron en frascos y en refrigeración.
Liofilización de la muestra
El primer paso fue congelar las muestras en un refrigerador (So-Low 2-8254) durante 3 días, posteriormente se colocó en las jarras del liofilizador (LABCONCO VWR26671-581 139154), bajo las condiciones de temperatura a -52°C ± 2°C y presión 0.040mBar, durante 3 días. Después se colocaron en bolsas herméticas para ser almacenadas.
Homogenizar el tamaño de partícula
Después para proceder a homogeneizar el tamaño de la partícula se trituró en una licuadora (Osterizer de 10 velocidades), y posteriormente se molió en un molino, el polvo resultante se tamizará para homogeneizar el tamaño de la partícula.
Se utilizó un procesador ultrasónico 1500 W (VCX 1500 HV Sonics & Materials, Inc., Newtown, CT, USA) con una sonda de 13 mm diámetro. Las muestras se procesaron a una frecuencia constante de 20 kHz con una amplitud que se varió entre 80-90% y tiempo de tratamiento entre 5-15 min, las duraciones del pulso variaron de 2s en y fuera de 4s. La temperatura de la muestra se controló usando un recipiente con camisa de 400 ml a través de la cual el agua a 30-40 ° C se distribuyó en caudal en 0,5 L / min. baño)
Diseño experimental
Los datos fueron analizados utilizando una metodología de superficie de respuesta (RSM). El diseño experimental utilizado fue un diseño central compuesto por dos variables independientes cada una a cinco de dos niveles. Las variables independientes, amplitud (X1,%) y tiempo de sonicación (X2, min), se seleccionaron sobre la base de los valores obtenidos en los experimentos preliminares. La amplitud se varió entre 80-90% y tiempo de tratamiento entre 5-15 min, y una temperatura de salida de 40 ° C ± 2 ° C.
Los datos experimentales se analizaron mediante regresión de superficie de respuesta (JMP 7.0.2) y se ajustaron a un modelo polinomial de segundo orden (Eq. 3).
Donde Yi es la respuesta predicha, b0 el coeficiente constante, b1, b2 el coeficiente lineal, b11 y b22 el coeficiente cuadrático, b12 es los coeficientes de productos cruzados.
La validez del modelo se determinó mediante la comparación de los valores experimentales y predichos.
Determinación de fenoles totales
Para la determinación de compuestos fenólicos totales se realizó por el método espectrofotométrico que utiliza el reactivo de Folin y Ciocalteu debido a su carácter reductor. Se colocaron en un vial Eppendorf 100µL de muestra la cual se hizo reaccionar con 500µL del reactivo de Folin-Ciocalteu utilizando una dilución de 1:10, agitándose en un Vortex (MIXER, L-VM1000) y dejando reaccionar durante 30min, se les adicionó 400µL de solución saturada de carbonato de sodio agitándose en un Vortex para homogeneizar y se colocaron 200µL en una microplaca de fondo plano, la absorbancia se midió en un lector de microplacas (Power Wave XS UV-Biotek, software KC Junior, USA) (Sun et al., 2007). Los resultados se expresaron en mg equivalentes de ácido gálico por 100gr de muestra en base seca.
Determinación de Ácido Ascórbico
Se tomaron 100µL de los extractos de las muestras a los que se les agregó 100µL de amortiguador (acetato de sodio/agua destilada/ácido acético glacial) y 800µL reactivo DCPI (2,6-diclorofenolinofenol) y se agitaron en Vórtex, después se midió la absorbancia en microplaca colocando 200µL por pozo y se leyó la absorbancia a 520nm utilizando ácido oxálico como blanco (Torregrosa, 2006), los resultados se expresaron en mg equivalentes de ácido ascórbico por 100g de muestra en base seca.
Determinación de actividad antirradical DPPH• (1,1 difenil-2-pricrilhidracil)
El radical DPPH• se evaluó de acuerdo a la metodología reportada por Morales y Jiménez-Pérez (2001). Para la determinación se preparó una solución con 7.4mg DPPH• en 10mL de etanol. Se tomó una alícuota de 100mL de los extractos obtenidos, y 500µL de solución de DPPH•, se agitaron con vortex y se dejaron reposar durante una hora. Transcurrido el tiempo se midió la absorbencia en el lector de microplacas a 520nm. El resultado se interpoló con una curva patrón de Trolox, a una concentración 0-300µM/ETOH, la actividad antioxidante se expresó en µmol de Trolox por 100g de muestra en base seca.
Determinación de actividad antirradical ABTS•+ (2,2´-azino-bis-(3-etilbenzotiazolin-6-sulfónico)
El método se basa en la atracción del radical catión ABTS•+ en presencia de un medio antioxidante. El radical catión ABTS•+ (7mM) se genera por la oxidación de la reacción del persulfato de potasio (2.45mM) que se dejó en obscuridad a temperatura ambiente durante 16 horas, posteriormente se llevó a una dilución con etanol hasta conseguir una absorbancia de 0.70±0.1 a 754nm. Se tomaron 980µL de la solución ABTS•+ previamente diluida y se colocaron en viales Eppendorf de 2mL, después se agregaron 20µL de muestra, se homogeneizaron y se dejaron reaccionar durante 7min, se continuo su lectura en el lector de microplacas 754nm. El resultado se interpoló con una curva patrón de Trolox, a una concentración 0-300µM/ETOH, la actividad antioxidante se expresó en µmol de Trolox por 100g de muestra en base seca.
Se realizaron dos métodos de extracción convencional (acuosa e hidroalcohólica):
En un vaso de precipitado se colocaron 20g de muestra a los que se les agregaron 160ml de agua, se homogeneizaron (WiseStir HS-SOA) durante 1 hora a 2000rpm, después se centrifugaron durante 30min a 10000rpm, el sobrenadante se vertió en un vaso de precipitado, mientras que al sedimento se le agregaron 80ml de agua y se homogeneizo nuevamente durante 30min a 2000rpm, a continuación se volvió a centrifugar durante 30min a 10000rpm, el sobrenadante se mezcló con el anterior, y al sedimento se le agregaron 80ml de agua y el cual se homogeneizo durante 30min a 2000rpm, se centrifugó durante 30min a 10000rpm, finalmente el sobrenadante se mezcló con los anteriores y se almacenó (el método es el mismo a seguir con etanol al 80%), esto se realizó con la finalidad de comparar con el extracto termoultrasonicado.
Los resultados se presentaron con la media y desviación estándar de cada medición. Los datos fueron analizados mediante la prueba paramétrica de Análisis de Varianza (ANOVA) de dos vías con una prueba post test de Tukey y se consideró estadísticamente significativo el valor de p menor o igual de 0.05. Para este análisis se utilizó el programa IBM SPSS Statistics 20.
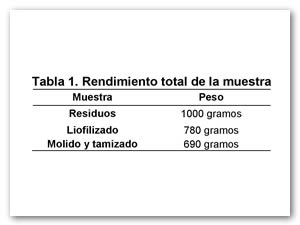
Una vez que se liofilizaron los residuos de mango se logró una disminución en el peso de 20% respecto al original (Barresi et al., 2009), en la tabla 1 se muestra el peso neto del despulpado liofilizado, cabe mencionar que debido a la liofilización el tiempo de conservación sin refrigeración aumenta, debido a la reducción del contenido de agua el cual inhibe la acción de los microorganismos patógenos que podrían deteriorar los alimentos. (Kasper & Friess, 2011).
Una vez liofilizado se procedió al molido y tamizado de los residuos, en la tabla 1 se presenta el peso final del residuo, debido a este proceso se obtuvo un polvo el cual se sometió a termoultrasonido para extraer los componentes antioxidantes.
En la tabla 2 se muestran las variables independientes que fueron tomadas en cuenta para desarrollar el diseño de superficie de respuesta, el intervalo de amplitud fue de 80 a 90% y entre 5 y 15 minutos, en total se designaron 13 experimentos de los cuales 8 fueron experimentos factoriales y 5 puntos centrales para estimar los errores en la MSR, dichos puntos fueron bajo las condiciones de 85% de amplitud a 10 minutos del tratamiento por termoultrasonido. La temperatura también es un factor importante en la extracción de compuestos sensibles al calor, la temperatura de salida de las muestras fue controlada a 40 ± 2 °C [Zou, T. et al. 2011], ya que los compuestos fenólicos son termo sensibles y pueden desnaturalizarse a altas temperaturas [Wang, X. et al. 2012, Chia-Hung, K. et al. 2014]. La proporción solido-liquido fue 1-25, es decir que por cada gramo de residuo en polvo se utilizaron 25 mililitros de agua.
Cuantificación de componentes antioxidantes
En la tabla 3 se encuentran los datos de la cuantificación de compuestos antioxidantes en los residuos de mango antes del tratamiento por termoultrasonido, mientras que en la tabla 4 se muestra los valores obtenidos de las variables de respuesta de los componentes de residuos de mango, el valor de fenoles totales varió entre 8137.68 a 9227.17 mg EAG/100g bs, se observó un aumento comparado con la concentración control en el que se obtuvo 3419.13 mg EAG/100 g bs, además presentan un mayor contenido en comparación con el níspero (437 mg EAG/100g bs) [Zhang, W. et al. 2015], manzana (328.52 mg EAG/100g bs) [Chien, H. et al. 2013], pera (231.74 mg EAG/100g bs), papaya (783.37 mg EAG/100g bs) e incluso mango (417.04 mg EAG/100g bs) [da Silva, L. et al. 2014], grosella (1053.43 mg EAG/100g bs) [da Silva, L. et al. 2014] y curuba (1010 mg EAG/100g bs) [Vasco, C. et al. 2008], la piña (2787.09 mg EAG/100g bs), cereza (7265.29 mg EAG/100g bs), guayaba (1987.19 mg EAG/100g bs), mora (2167 mg EAG/100g bs) y solo menor que el zapote (12696.03 mg EAG/100g bs) (da Silva et al., 2014).
En cuanto al ácido ascórbico se encuentra entre 5366.8 a 6040.2 mg AA/100g bs, también aumento considerablemente ya que los residuos sin tratamiento presentaron 2260.86 mg AA/100g bs, los valores encontrados fueron mayor que el contenido de polifenoles reportado en la manzana (600 a 1400 mg /100 g de peso fresco) [Hofer, M et al. 2005] y la fresa (500 a 1120 mg /100g de peso fresco) [Sturma, M. et al. 2003], sin embargo son parecidos a los reportados en saúco, que contienen 4480 a 6380 mg /100g de peso fresco (Veberic et al., 2009).
Actividad antirradical
La actividad antirradical se evaluó DPPH• y ABTS•+, en caso de DPPH• se presentó de 49825 a 66365 µM ET/100g bs y en ABTS•+ entre 65437.5 a 87833.33 µM ET/100g bs (tabla 4), en ambos se observó un gran aumento en la capacidad antioxidante en comparación con los residuos de mango sin tratamiento ya que presentaron 23693 y 30425 µM ET/100g bs respectivamente (tabla 3).
La actividad antioxidante determinada por DPPH• fue mayor que en la uva 1050.59 [Ky, I. & Pierre-Louis, T. 2015] y níspero 585 μmol ET/100g [Zhang, W.et. al. 2015], la piña (2285 μmol ET/100g), mora (4100 μmol ET/100g), capulin (7600 μmol ET/100g), curuba (7000 μmol ET/100g) y mango (17995.4 μmol ET/100g db) (Vasco et al., 2008)
La actividad antioxidante determinada por ABTS•+ presentaron resultados mayores que en mango reportados por Sogi, D. et al. [2013] los cuales fueron de 17240.9 µM TE/ 100g bs, uva 2432.62 µM ET/ 100g BS [Ky, I. & Pierre-Louis, T. 2015] y níspero ABTS•+ 5732 µM ET/100g BS (Zhang et al., 2015).
De acuerdo a los resultados se puede decir que el contenido de fenoles totales se correlaciona positivamente con la actividad antioxidante, lo que significa que a mayor presencia de polifenoles mayor actividad antioxidante, cabe mencionar que la extracción por termoultrasonido aumento 2.5 veces la concentración de los componentes antioxidantes comparada con la muestra que no recibió tratamiento. Sin embargo la cuantificación del poder antioxidante depende del tipo de método usado y el parámetro de referencia con el cual se mide (Ho, S. et al., 2014).
Efecto del porcentaje de amplitud en el rendimiento de los componentes antioxidantes
El proceso de extracción se llevó a cabo utilizando parámetros de amplitud de 80 a 90%, la tabla 5 muestra el análisis de varianza de los parámetros de regresión del modelo de predicción y los coeficientes de regresión correspondientes. El modelo indica que la amplitud (aA) favorece el contendido de fenoles totales con una p<0.05, así como el de ácido ascórbico con una p<0.01 y DPPH• p<0.05. En términos cuadráticos la variable “aAA” favorece la concentración de ABTS•+ presentando una p<0.001, y de menor forma a los fenoles totales y ácido ascórbico con una p<0.01.
Efecto del tiempo de sonicación en el rendimiento de los componentes antioxidantes
El ultrasonido podría acelerar el establecimiento de un equilibrio para la disolución de los compuestos diana entre la pared celular vegetal y el disolvente de extracción en un corto tiempo (Zou, T. et al., 2014). Sin embargo los componentes podrían ser degradados después de una larga exposición a la irradiación ultrasónica, haciendo que el rendimiento disminuya (Zou, T. et al., 2011). Los parámetros del tiempo de sonicación utilizados fueron de 5 a 15 minutos, en la tabla 5 se muestra el coeficiente de regresión de la variable del tiempo de sonicación (aT), la cual indica que en términos lineales el tiempo afecta favorablemente al contenido de fenoles totales, ácido ascórbico y ABTS•+ (p<0.001). En términos cuadráticos la variable “aTT” afecta positivamente las concentraciones de ácido ascórbico con un nivel de p<0.0001, sin embargo para fenoles totales y DPPH• se ven afectados con una p<0.05.
En cuanto a la interacción de las variables amplitud y tiempo de extracción (aAT), la concentración de fenoles totales y DPPH• mostraron una p<0.0001, mientras que ácido ascórbico y ABTS•+ p<0.001.
En la figura 1 se muestran los gráficos tridimensionales de superficie de respuesta, en la figura 1-A se observa el comportamiento en la concentración de fenoles totales considerando la interacción amplitud y tiempo de extracción, en donde podemos ver que a mayor amplitud y poco tiempo de extracción se logra un aumento en la concentración de componentes fenólicos, sin embargo a menor amplitud y mayor tiempo, el rendimiento se ve afectado. Así mismo en la figura 1-B se muestra la concentración de ácido ascórbico, en donde se observa que a mayor amplitud y menor tiempo de extración se observan valores más bajos, en cambio sí se aumenta la amplitud y el tiempo se pueden obtener mejores resultados. En cuanto a los datos de la actividad antirradical evaluada por DPPH• (fig. 1-C) se aprecia que con menor amplitud y tiempo los resultados obtenidos son bajos, pero al aumentar la amplitud se observa un incremento de los mismos, mientras que evaluada por ABTS•+ (fig. 1-D) apreciamos que a mayor amplitud y poco tiempo de extracción son afectados los resultados, pasa lo contrario si se aumenta la amplitud y el tiempo ya que se obtienen mejores resultados.
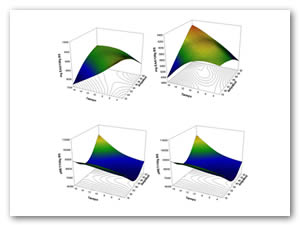
Figura 1. Gráficos de superficie de respuesta para los efectos en la concentración de componentes antioxidantes en relación con la amplitud (aA) y el tiempo de extracción (aT).
a) Fenoles totales, B) Ácido ascórbico, C) DPPH, D) ABTS
+
En la figura 2 se presenta la optimización de superficie de respuesta por superposición de gráficos de contorno, en donde se utilizaron los resultados de la extracción de compuestos fenólicos, ácido ascórbico, actividad antirradical ABTS•+ y DPPH•, el cual fue utilizado para determinar el punto más deseable. Los valores óptimos de las variables seleccionadas se obtuvieron mediante la resolución de la ecuación de regresión. Como puede observarse el área entre el círculo rojo muestra las condiciones en las que coincidían las concentraciones de los componentes las cuales fueron con una amplitud de 90 a 92% y tiempo de 6 a 8 minutos, por lo cual se decidió que las condiciones óptimas para la extracción serían a 91% de amplitud y 7 minutos de tratamiento por termoultrasonido. Los resultados esperados con estas condiciones para fenoles totales son 8800mg EAG/100g bs, ácido ascórbico 5600 mg EAA/100g bs, DPPH• 60000 µM ET/100g bs y ABTS•+ 75000 µM ET/100g bs. Para confirmar estos resultados, se realizaron ensayos por triplicado en condiciones optimizadas.
En cuanto a la comparación de los métodos de extracción podemos decir que no se observaron diferencias considerables entre los métodos convencionales (acuosa e hidroalcohólica), al comparar estos métodos con el de extracción por termoultrasonido, se observa un incremento significativo en la concentración de componentes antioxidantes y aumento en la actividad antioxidante.
En la figura 3A se muestra el contenido de fenoles totales, el método de extracción por termoultrasonido dio como resultado el contenido más alto (8837.68 mg EAG/100g bs), mientras que el método de extracción hidroalcohólica mostró el contenido más bajo (5223.16 mg EAG/100g bs), se observa el mismo comportamiento para el ácido ascórbico (fig. 3B), ya que la extracción por termoultrasonido presenta los mejores resultados (5730.67 mg EAA/100g bs), mientras que las extracciones acuosa e hidroalcohólica presentan concentraciones menores en promedio de 3700 mg EAA/100g bs. Para la actividad antioxidante medida por DPPH• (fig 3C) el mejor resultado lo presenta el método por termoultrasonido con 60080 µM ET/100g bs, y medida por ABTS•+ (fig. 3D) 76618 µM ET/100g bs, cabe mencionar que no se observa diferencia significativa entre los métodos convencionales para la actividad antioxidante.
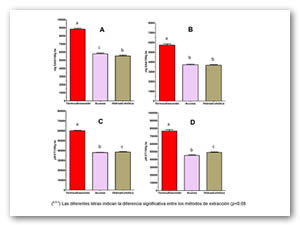
Figura 3. Comparación de la extracción de componentes antioxidantes y actividad antioxidante por diferentes métodos de extracción
A) Fenoles totales, B) Ácido ascórbico, C) DPPH, D) ABTS.+
La extracción por termoultrasonido demostró ser la mejor opción para la extracción de los componentes antioxidantes derivados de los subproductos industriales del mango variedad Ataulfo, el cual se somete a una amplitud de 91% durante 7 minutos, siendo posible obtener soluciones acuosos con alta actividad antioxidante desde el punto de vista nutracéutico, demostrando ser el más eficiente y el que requiere menos tiempo para la extracción de estos componentes. Además, debido a que son los residuos de mango los utilizados, podemos aprovechar una mayor cantidad de fruta, disminuyendo de ese modo los residuos resultantes de la agroindustria de mango.
Ajila, C., Naidu, K., Bhata, S. & Prasada U. (2007). Bioactive compounds and antioxidant potencial of mango peel ectract. Food Chemistry, 105(3), 982-988
Barbosa-Cánovas, G. V., Swanson, B. G., & Fernández-Molina, J. J. (2001). Tecnologías emergentes para la conservación de alimentos sin calor. Arbor: Ciencia, pensamiento y cultura, (661), 155-170.
Barresi, A., Pisano, R., Fissore, D., Rasetto, V., Velardi, S., Vallan, A., Parvis, M. & Galan, M. (2009) Monitoring of the primary drying of a lyophilization process in vials. Chemical Engineering and Processing, 48 (2), 408–423
Chia-Hung, K., Bao-Yuan, C., Yung-Chuan, L., Chieh-Ming J., C., Tzu-Shing, D., Jiann-Hwa, C. & Chwen-Jen, S. (2014). Optimized Ultrasound-Assisted Extraction of Phenolic Compounds from Polygonum cuspitatum. Molecules 19 (1), 67-77.
Chien, H., Chung, L., Adam, F., Aneta, W. & Maciej, O. (2013) Colour, phenolic content and antioxidant capacity of some fruits dehydrated by a combination of different methods. Food Chermistry. 141, 3889-3896
da Silva, L. M. R., de Figueiredo, E. A. T., Ricardo, N. M. P. S., Vieira, I. G. P., de Figueiredo, R. W., Brasil, I. M., & Gomes, C. L. (2014). Quantification of bioactive compounds in pulps and by-products of tropical fruits from Brazil.Food chemistry, 143, 398-404.
Dolores, M., Sánchez, I., de la Llana, M. & Gil, M. (2012). Innovaciones en el procesado de alimentos: Tecnologías no térmicas. Revista de Medicina de la Universidad de Navarra, 50(4), 71-74.
Engels, C., Knodler, M., Zhao, Y., Carle, R., Ganzle, M. & Schieer, A. (2009). Antimicrobial activity of allotannins isolated from mango (Mangifera indica L.) kernelrs. Journal of agriculture and food Chemistry. 57 (17), 7712-7718.
Estrada, R., Ruiz, F. & Martínez, H. (2012). Extracción de compuestos fenólicos totales de residuo de mango común (Mangifera indica L.) empleando ultrasonido. Acta Agronómica 61(5). 95-96.
Faerman, V., Mukmenev, I. & Shreiber, I. (2002). Sonication of Microalgae and its Precipitation. Acta Acustica united with Acustica, 88(4), 592-593.
González, A., Viatcheslav, K. & Guzmán M. (2009). Desarrollo de métodos de extracción de aceite en la cadena de producción de biodiesel a partir de microalgas. Prospect, 7(2), 53-60.
Guzman, O., Lemus, C., Bujari, J., Bonilla, J.,. & Ly, J.(2010). Ensilado de residuos de mango (Mangifera indica L.) para la alimentación animal. Caracteristicas fermentativas. Computadorizada de Producción Porcina. 17(3), 218-223.
Guzmán, O., Lemus, C., Martínez, S., Bonilla, J., Plasencia, A., & Ly, J. (2012). Características químicas del ensilado de residuos de mango (Mangifera indica L.) destinado a la alimentación animal. Revista Cubana de Ciencia Agrícola, 46(4), 369-374.
Herrero A. M. & Romero de Avila M. D. (2006). Innovaciones en el procesado de alimentos: Tecnologías no térmicas. Revista de medicina, 50(4), 71-74.
Ho, S. K., Tan, C. P., Thoo, Y. Y., Abas, F., & Ho, C. W. (2014). Ultrasound-Assisted Extraction of Antioxidants in Misai Kucing (Orthosiphon stamineus).Molecules, 19(8), 12640-12659.
Hofer, M., Herbinger, K., Hecke, K., Toplak, H., Veberic, R., Monschein, S., Stampar, F., Keppel, H. Grill, D. et al. (2005) Inhaltsstoffe alter Apfelsorten unter diatetischem Aspekt-Schwerpunkt diabetes. Journal für Ernährungsmedizin. 7 (1), 30–33.
Kasper, J. & Friess, W. (2011) The freezing step in lyophilization: Physico-chemical fundamentals, freezing methods and consequences on process performance and quality attributes of biopharmaceuticals. European Journal of Pharmaceutics and Biopharmaceutics, 78(2), 248–263
Ky, I., & Teissedre, P. L. (2015). Characterisation of Mediterranean Grape Pomace Seed and Skin Extracts: Polyphenolic Content and Antioxidant Activity. Molecules, 20(2), 2190-2207.
Lurrauri, J., Rupérez, P., Borroto, B. & Saura-Calixto, F. (1996). Mango peles as a new tropical fiber: preparation and characterization. Lebensm-wiss technology, 10, 3-8.
Porras, O., González, G., Castellanos, A., Ballesteros, J. & Pacheco, M. (2011). Efecto de la aplicación de ondas de ultrasonido sobre las propiedades fisicoquímicas, reológicas y microbiológicas de pulpa de mango (mangifera indica l.) Variedad común. Alimentos Hoy, 20(23), 53-78.
Quintero, V., Giraldo, G., Lucas, J. & Vasco, J. (2013). Physicochemical characterization of the common mango (mangifera indica l.) During ripening process. Biotecnología en el Sector Agropecuario y Agroindustrial, 11 ( 1), 10-18.
Rodriguez, K., Aranguren, M., Pérez, J., Farrés, E., Placeres, J., Alonso, M. & Rodriguez, G. (2012). Effects of Paclobutrazol on vegetative development and blooming start in two mango cultivars (Mangifera indica L.) in Jaguey Grande conditions. Centro Agrícola, 39(1), 5-10.
Schieber, A., Hilt, P., Berardini, N., & Carle, R. (2004). Recovery of pectin and polyphenolics from apple pomace and mango peels. Total food, 144-149.
Sogi, D. S., Siddiq, M., Greiby, I., & Dolan, K. D. (2013). Total phenolics, antioxidant activity, and functional properties of ‘Tommy Atkins’ mango peel and kernel as affected by drying methods. Food chemistry, 141(3), 2649-2655.
Sogi, D. S., Siddiq, M., Roidoung, S., & Dolan, K. D. (2012). Total Phenolics, Carotenoids, Ascorbic Acid, and Antioxidant Properties of Fresh‐cut Mango (Mangifera indica L., cv. Tommy Atkin) as Affected by Infrared Heat Treatment. Journal of food science, 77(11), C1197-C1202.
Sturm, K., Koronb, D., Stampara, F. (2003) The composition of fruit of different strawberry varieties depending on maturity stage. Food Chemistry, 83, 417–422.
Sudhakar, D. & Maini, S. (2000). Isolation and characterization of mango peel pectics. Journal of Food Processing and Preservation, 24(3), 209-227.
Vasco, C., Ruales, J & Kamal-Eldin, A. (2008) Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food chemistry,111(4), 816-823
Veberic, R., Jakopic, J., Stampar, F., & Schmitzer, V. (2009). European elderberry (Sambucus nigra L.) rich in sugars, organic acids, anthocyanins and selected polyphenols. Food Chemistry, 114(2), 511-515.
Wang, H. W., Liu, Y. Q., Wei, S. L., Yan, Z. J., & Lu, K. (2010). Comparison of microwave-assisted and conventional hydrodistillation in the extraction of essential oils from mango (Mangifera indica L.) flowers. Molecules, 15(11), 7715-7723.
Wang, X., Wu, Q., Wu, Y., Chen, G., Yue, W., & Liang, Q. (2012). Response surface optimized ultrasonic-assisted extraction of flavonoids from Sparganii rhizoma and evaluation of their in vitro antioxidant activities. Molecules, 17(6), 6769-6783.
Zhang, W., Zhao, X., Sun, C., Li, X., & Chen, K. (2015). Phenolic composition from different Loquat (Eriobotrya japonica Lindl.) cultivars grown in china and their antioxidant properties. Molecules, 20(1), 542-555.
Zou, T. B., Wang, M., Gan, R. Y., & Ling, W. H. (2011). Optimization of ultrasound-assisted extraction of anthocyanins from mulberry, using response surface methodology. International journal of molecular sciences, 12(5), 3006-3017.
Zou, T. B., Xia, E. Q., He, T. P., Huang, M. Y., Jia, Q., & Li, H. W. (2014). Ultrasound-assisted Extraction of Mangiferin from Mango (Mangifera indica L.) leaves using response surface methodology. Molecules, 19(2), 1411-1421.
[a] Centro de Investigación Interdisciplinario. Área Académica de Nutrición, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo.
[b] Secretaria de Investigación y Estudios de Posgrado, Autonomous University of Nayarit, Ciudad de la Cultura “Amado Nervo”.
[c] Centro de Investigación Interdisciplinario. Área Académica de Medicina, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo.
Correo de correspondencia: nerias_ssj@hotmail.com