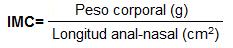Efecto de un microencapsulado de jugo de granada roja en ratones cd-1 diabéticos y alimentados con una dieta aterogénica
Effect of a microencapsulated of red pomegranate juice in diabetic cd-1 mice and fed with an atherogenic diet
Betanzos Cabrera G [a],
Izquierdo Vega JA [b]
Álvarez Cervantes P [c]
Resumen
La ateroesclerosis y la diabetes mellitus encuentran entre las primeras causas de muerte a nivel mundial y en México, presentando así un problema de salud pública. Una posible alternativa para la prevención y tratamiento es la granada, un fruto rico en compuestos polifenólicos, que le confieren propiedades terapéuticas a la salud como: antioxidante, antihipertensivo, hipoglucemiante, antiaterogénico entre otros. Sin embargo, la granada no se encuentra disponible durante el año. No obstante, la microencapsulación es un método de conservación, que protege compuestos bioactivos presentes en los alimentos. Por lo que el objetivo del estudio, es evaluar el efecto de la administración subcrónica de un microencapsulado de jugo de granada roja (MJGR) en ratones CD-1 con diabetes inducidos por estreptozotocina y alimentados con una dieta aterogénica. In vivo se determinará el Índice de Masa Corporal, daño y estrés oxidativo, capacidad antioxidante, indicadores bioquímicos, presión arterial y estudios histológicos de aorta, hígado y riñón. Se espera que el MJGR proteja de los cambios en las variables de estudio. De ser así, el MJGR podría utilizarse como producto nutracéutico en diabetes mellitus y ateroesclerosis.
Palabras clave: ateroesclerosis, diabetes mellitus, granada, microencapsulado de jugo de granada roja.
Abstract
Atherosclerosis and diabetes mellitus are among the leading causes of death worldwide and in Mexico, thus presenting a problem of public health. A possible alternative for the prevention and treatment is the pomegranate, a fruit rich in polyphenolic compounds, which confer therapeutic health properties such a: antioxidant, antihypertensive, hypoglycemic, antiatherogenic and others. However, the pomegranate is not available during the year. However, microencapsulation is a method of conservation, which protects bioactive compounds present in food. The aim of the study is to evaluate the effect of subchronic administration of microencapsulated of red pomegranate juice (MRPJ) in streptozotocin-induced diabetic CD-1 mice and fed with an atherogenic diet. In vivo the Body Mass Index, damage and oxidative stress, antioxidant capacity, biochemical markers, blood pressure and histological studies of aorta, liver and kidney will be determined. MRPJ is expected to protect of the changes in the study variables. If so, the MRPJ could be used as nutraceutical product in diabetes mellitus and atherosclerosis.
Keywords: atherosclerosis, diabetes mellitus, pomegranate, microencapsulated of red pomegranate juice.
1. Introducción
1.1 Diabetes mellitus (DM)
1.1.1 Definición y descripción de la DM
La DM es una enfermedad metabólica caracterizada por hiperglucemia crónica resultado de los defectos en la secreción o acción de la insulina, o ambos (American Diabetes Association, 2014a;
Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013;Kerner & Bruckel, 2014) . La hiperglucemia crónica de la diabetes se asocia con complicaciones microvasculares a largo plazo, que afectan a diferentes órganos, especialmente los ojos, riñones, nervios, corazón, además incrementa el riesgo de enfermedades cardiovasculares (American Diabetes Association, 2014a; Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013).
Varios procesos patológicos están involucrados en el desarrollo de la diabetes. Estos van desde la destrucción autoinmune de las células β del páncreas con la deficiencia de la insulina consecuente con las anormalidades que resulta la resistencia a la acción de la insulina. La base de las anormalidades en el metabolismo de carbohidratos, grasas y proteínas en la diabetes es la acción deficiente de insulina en los tejidos diana. La deficiente acción de la insulina resulta desde una inadecuada secreción de insulina y/o disminución en los tejidos diana (American Diabetes Association, 2011).
Los síntomas de la hiperglucemia incluyen poliuria, polidipsia, pérdida de peso, a veces con polifagia y visión borrosa. El deterioro del crecimiento y la susceptibilidad a ciertas infecciones también puede acompañar la hiperglucemia crónica (American Diabetes Association, 2014a).
Las complicaciones a largo plazo de la diabetes incluyen retinopatía con pérdida potencial de la visión; nefropatía que lleva a la insuficiencia renal; neuropatía periférica con riesgo de úlceras en los pies, amputaciones y articulaciones de Charcot (enfermedad articular neuropática); y neuropatía autonómica causando síntomas gastrointestinales, genitourinarios, cardiovasculares y disfunción sexual. Los pacientes con diabetes tienen una mayor incidencia de enfermedades cardiovasculares ateroscleróticas, enfermedad arterial periférica y enfermedad cerebrovascular. La hipertensión y anormalidades del metabolismo de las lipoproteínas se encuentran frecuentemente en las personas con diabetes (American Diabetes Association, 2014a).
1.1.2 Clasificación y diagnóstico de DM
a) Clasificación de DM
La DM incluye cuatro clases clínicas:
-
Diabetes tipo 1 (DM 1). Es el resultado de la destrucción de las células β, por lo general conduce a una deficiencia absoluta de insulina y es tendente a cetoacidosis, representa tan sólo del 5 al 10% de las personas con diabetes (American Diabetes Association, 2014a). Esta forma de diabetes incluye los casos debido a un proceso autoinmune, la cual se desconoce la etiología de la destrucción de las células β (Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013).
- Diabetes tipo 2 (DM 2). Este tipo puede variar desde una acción predominante debilitada de la insulina con deficiente relativa en la secreción de la insulina, hasta un defecto secretor predominante con acción debilitada de la insulina (American Diabetes Association, 2014a, 2014b; Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013; Kerner & Bruckel, 2014) . La DM 2, corresponde del 90 al 95% de las personas con diabetes (American Diabetes Association, 2014a)
- Otros tipos específicos de diabetes debido a otras causas, por ejemplo, defectos genéticos en la función de células β, los defectos genéticos en la acción de la insulina, enfermedades del páncreas exócrino, endocrinopatías, diabetes inducida por drogas o compuestos químicos, infecciones, formas no comunes de diabetes mediada por inmunidad y otros síndromes genéticos asociados en ocasiones con diabetes (American Diabetes Association, 2011, 2014a, 2014b; Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013; Kerner & Bruckel, 2014) .
- Diabetes gestacional (DG). Se define como cualquier grado de intolerancia a la glucosa que inicia o es reconocida en primer lugar durante la gestación (American Diabetes Association, 2011, 2014a, 2014b; Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013; Kerner & Bruckel, 2014) .
b) Diagnóstico de DM
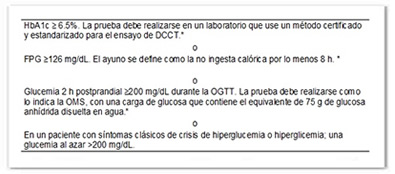
La diabetes usualmente es diagnosticada con base a los criterios de glucosa en plasma, ya sea una glucosa plasmática en ayunas (FPG, por sus siglas en inglés) o una glucosa en plasma (PG, por sus siglas en inglés) a las 2-h durante una prueba de tolerancia oral a la glucosa (OGTT, por sus siglas en inglés,) o una glucosa casual con los síntomas clásicos de hiperglucemia (American Diabetes Association, 2014a, 2014b) .
Sin embargo, a partir del 2010 expertos de la Asociación Americana de Diabetes (ADA, por sus siglas en inglés) añadieron la hemoglobina glicosilada (HbA1c) como una herramienta para el diagnóstico correcto de DM (Kerner & Bruckel, 2014). En la Tabla 1 se resumen los criterios de diagnóstico de diabetes.
1.1.3 Fisiopatología
La DM 1 es una enfermedad crónica determinada por la hiperglucemia secundaria a la producción inadecuada de insulina por el páncreas. Esto ocurre como resultado de la destrucción autoinmune de las células β productoras de insulina en los islotes de Langerhans (Eizirik, Colli, & Ortis, 2009; Ogbera, 2014; Thrower & Bingley, 2010) . Se caracteriza por una infiltración inflamatoria linfocitaria que afecta a los islotes pancreáticos, un proceso conocido como insulitis (Atkinson, Eisenbarth, & Michels, 2014; In't Veld, 2011; Thrower & Bingley, 2010) . El infiltrado está compuesto fundamentalmente de los linfocitos T o células T, en el que
dominan los linfocitos CD8+, pero también puede contener linfocitos CD4+, linfocitos B y macrófagos (In't Veld, 2011; Thrower & Bingley, 2010).
Tabla 1. Criterios de diagnóstico de DM
Por otro lado, la DM 2 es un trastorno metabólico de la homeóstasis de la glucosa que se caracteriza por la hiperglucemia crónica y alteración del metabolismo lipídico causado por los islotes de las células β, las cuales son incapaces de secretar suficiente insulina en respuesta a los diversos grados de ingesta excesiva de calorías, sedentarismo o inactividad física, consecuente sobrepeso u obesidad (Nolan, Damm, & Prentki, 2011), lo que resulta resistencia a la acción de la insulina sobre los tejidos periféricos además de una inadecuada secreción de insulina y un deterioro de la supresión de secreción de glucagón en respuesta a la ingestión de glucosa (Carrera-Boada & Martinez-Moreno, 2013; Smushkin & Vella, 2010) . Por lo tanto, la DMT 2 implica al menos dos mecanismos patológicos principales: (a) una disminución progresiva de la función celular de los islotes pancreáticos que resulta en reducción de la secreción de insulina y (b) la resistencia periférica a la insulina que resulta en una disminución en las respuestas metabólicas a la insulina (Carrera-Boada & Martinez-Moreno, 2013; Kahn, Cooper, & Del Prato, 2014; Nolan et al., 2011).
1.1.4 Epidemiología de la diabetes mellitus
La DM es una de las enfermedades crónicas más comunes en casi todos los países, la cual sigue aumentando en números y es debido al desarrollo económico y la urbanización que conduce a nuevos estilos de vida caracterizados por la falta de actividad física y el aumento de la obesidad (Whiting, Guariguata, Weil, & Shaw, 2011). En el 2013, la Federación Internacional de Diabetes (IDF, por sus siglas en inglés) indica que en todo el mundo, hay 382 millones de personas en edades de 20 a 79 años que se diagnosticaron portadoras de DM, de las cuales el 80% vive en los países de ingresos medios y bajos, donde viven cuatro de cada cinco personas con diabetes, y se calcula que en menos de 25 años, el total de personas afectadas aumentará a 592 millones (International Diabetes Federation, 2013; Whiting et al., 2011) .
Por otro lado, los países que encabezan por número de personas con diabetes entre edades de 20 a 79 años en el 2013 son: China, India y Estados Unidos de América con 98, 65 y 24 millones de personas con esta enfermedad, respectivamente. Mientras que México se encuentra en sexto lugar con 8.7 millones con diagnóstico de diabetes (International Diabetes Federation, 2013; Whiting et al., 2011).
Además, tanto en términos humanos como financieros, la carga de la diabetes es enorme. Provoca 5,1 millones de muertes (cada seis segundos una persona muere de diabetes). Derivado de lo anterior, 548 millones de dólares fueron gastos de salud (11% del gasto total en todo el mundo) en el 2013 y se estima que aumente a 627 millones de dólares en el 2035 (International Diabetes Federation, 2013).
En la información que corresponde a México, la DM constituye la primera causa de muerte a nivel nacional con 84,445 defunciones en el 2012, según datos del Conejo Nacional de Población (CONAPO). Asimismo, la Encuesta Nacional de Salud (ENSANUT) llevada a cabo en el 2012 reportó que hay 6.4 millones de personas diagnosticados con diabetes lo que representó el 9.2% con diagnóstico previo, del cual el 47% han recibido también diagnóstico de hipertensión arterial. También, del total de la población mayor a 20 años, el 4.3% vive con diabetes e hipertensión. Otro dato importante que se dio a conocer es que, los estados con mayor prevalencia de diabetes son: Distrito Federal, Nuevo León, Veracruz, Tamaulipas, Durango y San Luis Potosí, lo que significó un gasto de salud en su atención y complicaciones de 3,430 millones de dólares al año (Gutiérrez et al., 2012 ).
Respecto al estado de Hidalgo, el Instituto Nacional de Geografía y Estadística (INEGI) reporta que el 2012 las defunciones por parte de la diabetes fue de 1,831. Asimismo, en el 2012, la ENSANUT dio a conocer que la prevalencia de diabetes por diagnóstico previo en personas de 20 años o más fue de 8.2%, en comparación con los resultados nacionales, la prevalencia se ubicó debajo de la media nacional (18vo lugar) (Instituto Nacional de Salud Pública, 2013).
1.1.5 Destrucción de las células β-pancreáticas
La DM ocurre cuando las células β no funcionan correctamente o han sido destruidas. En gran medida en la homeostasis de la glucosa y la susceptibilidad a la diabetes son determinados por una masa de células β funcional. La masa de células β funcional es el producto del número de células β, el tamaño de las células β y la capacidad de las células β individuales para secretar insulina de manera correcta (Johnson & Luciani, 2010). Esto ha convertido cada vez más evidente que la apoptosis es probablemente la principal forma de muerte de las células β en DM 1 y 2 (Cnop et al., 2005; Johnson & Luciani, 2010; Melloul, 2008; Tanaka, Aida, Nishida, & Kobayashi, 2013) . La apoptosis de las células β puede ocurrir en respuesta a varios alteraciones que actúan a través de al menos tres vías: 1) la muerte celular inducida por citoquinas, mediada por receptores de muerte de la superficie celular, 2) alteración mitocondrial, por ejemplo, secundaria a radicales libres de oxígeno y 3) estrés del retículo endoplasmático (RE) (Lupi & Del Prato, 2008).
El proceso de la destrucción de las células β en la DM 1 comienza cuando los macrófagos y células dendríticas presentan antígenos de las células β a las células T CD4+ a través del complejo mayor de histocompatibilidad. A través de una serie de señalización de interleucina, se activan las células T CD4+, que a su vez activan las células T CD8+ que son responsables de causar la muerte de las células β. La muerte de las células β resulta en la liberación de antígenos intracelulares adicionales y permite células presentadoras de antígeno más el acceso a los antígenos propios típicamente secuestrados. El muestreo continuo de estos autoantígenos conduce a la activación de las células T autorreactivas adicionales a través de la amplificación de la respuesta autoinmune inicial (difusión de epítopo) (Gan, Albanese-O'Neill, & Haller, 2012; Thrower & Bingley, 2010) .
En un sistema inmune que funciona normalmente, las células T autorreactivas serían eliminadas, o su actividad serían controladas, por un número de mecanismos complementarios, lo que resulta en el sistema de tolerancia inmunológica. Se cree que la DM 1 resulta de la falla de uno o más de estos mecanismos (Thrower & Bingley, 2010).
En cambio, la destrucción de células β-pancréaticas en la DM 2, se asocia predominantemente con el aumento de citoquinas y en ácidos grasos libres (AGL) circulantes y con hiperglucemia constante, lo que conlleva a la deficiencia de la función y la disminución de masa de células β-pancréaticas (Wang, Guan, & Yang, 2010), por lo tanto las células β son afectadas por alteraciones metabólicas, es decir glucotoxicidad y lipotoxicidad (Carrera-Boada & Martinez-Moreno, 2013; Lupi & Del Prato, 2008) .
La glucotoxicidad se caracteriza por el aumento crónico de las concentraciones de glucosa en sangre que afecta la función de las células β y la sensibilidad a la insulina (Lupi & Del Prato, 2008).
Por otro lado, la lipotoxicidad es la exposición prolongada al aumento de los niveles de AGL (derivados de la lipólisis de los adipocitos o de la hidrólisis de proteínas) que tienen efectos negativos sobre la función de las células β y conducen a la acumulación de metabolitos tóxicos de AGL en las células de los islotes (Cernea & Dobreanu, 2013).
1.1.6 Estrés oxidativo y disfunción de las células β-pancréaticas
Las células β del páncreas se encuentran en una situación extraordinaria. Utiliza el catabolismo de la glucosa para satisfacer sus necesidades de energía, de la misma forma proporciona la energía necesaria para la biosíntesis de insulina y la exocitosis. Al mismo tiempo, la célula β genera dentro de este metabolismo la señal para la secreción de insulina inducida por la glucosa (Lenzen, 2008b).
Para su función como sensor de glucosa y productor de insulina, la célula β requiere un medio intracelular rico en oxígeno y de glucosa a fin de generar la señal para la secreción de insulina en su metabolismo de la glucosa y para suministrar adecuadamente los tejidos diana en la periferia con esta hormona indispensable para la regulación del metabolismo intermediario. La célula β es protegida débilmente contra la toxicidad de los radicales libres, limitando la capacidad de inactivación de EROs (Especies Reactivas de Oxígeno) por Superóxido Dismutasa (SOD), Catalasa y Glutatión Peroxidasa (GPx) (Lenzen, 2008b).
1.1.6.1 Especies reactivas
Las especies reactivas son moléculas pequeñas con un átomo de oxígeno o de nitrógeno en su estructura. Estos son EROs y ERNs (Especies Reactivas de Nitrógeno) que pueden ser radicales libres, con un electrón no apareado (por ejemplo: radical óxido nítrico (NO), radical superóxido (O2) y el radical hidroxilo (OH)) o los no radicales como peróxido de hidrogeno (H2O2); también pueden ser aniones (por ejemplo, superóxido (O2 ) y peroxinitrito (ONOO)) o no-iones (por ejemplo: H2O2, NO o OH) (Lenzen, 2008b).
1.1.6.2 Estrés oxidativo
El término de EROs se aplica a los radicales libres y sus intermediarios no radicales. Los radicales libres se definen como especies que contienen uno o más electrones no apareados, y es esta capa incompleta de electrones que confiere su alta reactividad (Burton & Jauniaux, 2011). Las EROs se forman después de la reducción incompleta de oxígeno molecular (Rains & Jain, 2011; Styskal, Van Remmen, Richardson, & Salmon, 2012) o por oxidación del agua (Rains & Jain, 2011) para producir productos como el anión de superóxido (O2), peróxido de hidrógeno (H2O2) y radical hidroxilo (OH) (Pitocco, Tesauro, Alessandro, Ghirlanda, & Cardillo, 2013; Rains & Jain, 2011) . Los factores que generan las especies reactivas del oxígeno (EROs) existen como productos de fisiología celular normal, así como de diversas fuentes exógenas (Styskal et al., 2012). Las mitocondrias y Nicotinamida Adenina Dinucleótido Fosfato (NADPH) son probablemente la de mayor fuente celular de EROs (Pitocco et al., 2013; Rains & Jain, 2011; Yan, 2014) , específicamente los radicales superóxido (Pitocco et al., 2013; Styskal et al., 2012) . Una gran cantidad de EROs en un sistema biológico puede llevar al daño celular de los lípidos, membranas, proteínas y ADN (Rains & Jain, 2011;
Styskal et al., 2012; Yan, 2014) . El óxido nítrico (NO) es otro factor de concentración de EROs y la formación de productos intermedios de ERNs. El NO es generado por óxido nítrico sintasas específicas que también contribuyen a un gran número de procesos fisiológicos. El NO puede reaccionar con el superóxido para formar un potente agente oxidante, el peroxinitrito (ONOO), lo que contribuye al daño celular y el estrés oxidativo (Lenzen, 2008b; Rains & Jain, 2011).
1.1.6.2.1 Estrés oxidativo y diabetes mellitus
El estrés oxidativo juega un papel importante en el desarrollo de las complicaciones de la DM (Giacco & Brownlee, 2010). Una actividad excesiva de oxidante es mecánicamente relacionada con diversas etiologías de la resistencia a la insulina y el desarrollo de la DM (Henriksen, Diamond-Stanic, & Marchionne, 2011). Hay muchas fuentes de estrés oxidativo en la DM incluyendo vías enzimáticas, no enzimáticas y mitocondriales. El aumento del estrés oxidativo en la DM se produce debido a múltiples factores (Zatalia & Sanusi, 2013). El factor más dominante es la glucosa auto-oxidación que resulta en el desarrollo de los radicales libres. Otros factores son el desequilibrio celular reducción/oxidación y la reducción de las defensas antioxidantes (incluyendo reducido nivel de antioxidante celular y la reducción de la actividad de enzimas contra los radicales libres) (Chaturvedi, 2007).
El aumento del nivel de glucosa extracelular es la característica principal de la DM, que inducirá la desregulación de las vías de generación de especies reactivas de oxígeno y de nitrógeno. El proceso dará lugar a la interrupción del endotelio vascular y producción de NO. El superóxido, cuando se combina con NO de las células endoteliales resultará en la formación de peroxinitrito, una especie reactiva de nitrógeno muy citotóxico (Robertson, Zhou, Zhang, & Harmon, 2007;Szabo, 2009).
El aumento de la producción de superóxido provoca la activación de cinco vías implicadas en la patogénesis de las complicaciones de la DM, es decir, la activación de flujo vía de los polioles, aumento de la formación de productos finales de glicación avanzada (AGEs), aumento de la expresión del receptor de AGEs y sus ligandos activadores, la activación de la proteína quinasa C (PKC) y la actividad excesiva de la vía hexosamina (Ceriello & Testa, 2009; Giacco & Brownlee, 2010). La sobreproducción de superóxido a través de la cadena de transporte de electrones mitocondrial durante la hiperglucemia puede convertirse en el factor desencadenante del proceso mencionado anteriormente (Zatalia & Sanusi, 2013).
En condiciones hiperglucémicas intracelulares, la glucosa a través de la vía de los polioles se convierte en polialcohol sorbitol, que a su vez, reduce las concentraciones intracelulares de los agentes antioxidantes NADPH y de glutatión y, en consecuencia, induce una sobreproducción de O2. La acumulación de EROs inhibe la glucosa-6-fosfato deshidrogenasa, una enzima que es necesaria para reducir equivalentes para el sistema antioxidante, amplificando el estrés oxidativo. Por otra parte, sorbitol es metabolizado a fructosa por la sorbitol deshidrogenasa, aumentando la relación intracelular de NADH/ NAD+ (Nicotinamida Adenina Dinucleótido), lo que conduce a una inhibición de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH); esto, a su vez, aumenta la concentración de triosa fosfato. Los niveles más altos de triosa fosfato promueven la formación de tanto metilglioxal, un precursor de los AGEs, y diacilglicerol (a través de glicerol-3 fosfato), activando de este modo PKC (Fiorentino, Prioletta, Zuo, & Folli, 2013).
1.1.7 Disfunción de células β-pancreáticas en DM experimental
Para la detección y el estudio detallado de los medicamentos antidiabéticos, se han utilizan diversos modelos experimentales genéticos y no genéticos de la DM. Los modelos experimentales diabéticos más comúnmente usados son modelos no genéticos que utilizan análogos de glucosa de las células β hidrófilos, tales como aloxano, estreptozotocina, clorozotocina, ciproheptadina, etc. En este tipo de modelos experimentales de DM, la estreptozotocina es el más utilizado (Smirnov, Snigur, & Voronkova, 2012.
1.1.7.1 Estreptozotocina (STZ)
La estreptozotocina (STZ) (2-deoxy-2-[3-(methyl1-3-nitrosoureido)-D-glucopiranosa] (Lenzen, 2008a) es un derivado de N-nitrosourea de D-glucosamina que se aisló primero de Streptomyces achromogenes. Es un antibiótico de amplio espectro y agente genotóxico alquilante que posee propiedades antibacterianas, tumoricidas, cancerígenos y diabetogénicos (Raza & John, 2012; Rees & Alcolado, 2005) . La STZ es altamente citotóxico para las células β-pancreáticas y por lo tanto es comúnmente usado para inducir diabetes experimental en rodantes (Raza & John, 2012), ya que se ha demostrado que interfiere en el transporte de glucosa, en la función de la glucoquinasa e induce múltiples roturas de la cadena de ADN (Rees & Alcolado, 2005).
1.1.7.1.1 Mecanismos de acción de STZ
Las células β del páncreas captan la STZ a través del transportador GLUT2, por lo que cuando se reduce la expresión de este transportador, se previene la acción diabetogénica de la STZ (Lenzen, 2008a;Szkudelski, 2001) . Posteriormente, los resultados en la acción intracelular de la STZ son los cambios de ADN en las células β del páncreas que comprende su fragmentación (Szkudelski, 2001). En general se supone que la toxicidad de estreptozotocina es dependiente de la actividad alquilante de ADN en relación con metilnitrosourea, sobre todo en la posición O6 de la guanina. La transferencia del grupo metilo de estreptozotocina a la molécula de ADN causa daños que a lo largo de una cadena definida de eventos, da como resultado la fragmentación del ADN (Lenzen, 2008a; Szkudelski, 2001) . La glicosilación de proteínas puede ser un factor perjudicial adicional. En el intento de reparación del ADN, poli (ADP-ribosa) polimerasa (PARP) es estimulado. Esto disminuye NAD+ celular, y a la postre ATP de reserva. El agotamiento de las reservas de energía celular en última instancia resulta en la necrosis de las células β. Aunque STZ también metila proteínas, la metilación del ADN es en última instancia, que es el responsable de la muerte de las células β, pero es probable que la metilación de proteínas contribuye a los defectos funcionales de las células β después de la exposición a estreptozotocina (Lenzen, 2008a).
Otra acción de STZ es su potencial para actuar como NO donante celular. De hecho, STZ libera NO y conduce a la destrucción de células de los islotes pancreáticos. Las células β-pancreáticas expuestas a STZ manifiestan cambios característicos del NO, es decir, aumento de la actividad de la adenilato ciclasa y la formación de cGMP (Lenzen, 2008a; Szkudelski, 2001) .
También se ha encontrado que STZ genera EROs, que contribuyen a la fragmentación de ADN y activa otros cambios nocivos en las células. La formación O2 resulta de la acción de la STZ en la mitocondria y el aumento de la actividad de la xantina oxidasa. Además se demostró que STZ inhibe el ciclo de Krebs y sustancialmente disminuye el consumo de oxígeno por las mitocondrias. Estos efectos limitan fuertemente la producción de ATP mitocondrial y causa disminución de este nucleótido en las células β (Szkudelski, 2001).
Por último, se ha establecido que no solo el potente de alquilación de STZ es la principal razón de su toxicidad. La acción sinergética de NO y EROs deberían también a contribuir a la fragmentación de ADN y otros cambios perjudiciales causados por STZ. El NO y EROs pueden actuar por separado o formar el ONOO un radical libre altamente tóxico (Szkudelski, 2001).
1.2 Ateroesclerosis
1.2.1 Generalidades de la ateroesclerosis
La ateroesclerosis es la principal causa de morbilidad y mortalidad a nivel mundial de las enfermedades cardiovasculares (ECV) (Frostegard, 2013; Kazemi-Bajestani & Ghayour-Mobarhan, 2013; Weber & Noels, 2011) . Las ECV comprenden una clase de enfermedades que implican el corazón y los vasos sanguíneos sistémicos. En la enfermedad coronaria, la enfermedad cerebrovascular o la enfermedad arterial periférica, existe una alteración de la función de los vasos sanguíneos que conlleva a un suministro inadecuado de la sangre a los órganos (Mangge, Becker, Fuchs, & Gostner, 2014).
De este modo, la ateroesclerosis se define como una enfermedad de la íntima vascular (Rafieian-Kopaei, Setorki, Doudi, Baradaran, & Nasri, 2014), caracterizada generalmente por los trastornos del metabolismo de los lípidos, principalmente Lipoproteínas de Baja Densidad (LDL) (Kazemi-Bajestani & Ghayour-Mobarhan, 2013), en el que todo el sistema vascular de la aorta a las arterias coronarias puede estar involucrado y es caracterizado por placas de la íntima (Rafieian-Kopaei et al., 2014).
El término de ateroesclerosis es de origen Griego, es decir, engrosamiento de la capa íntima de las arterias y la acumulación de grasa. El material graso se encuentra en el núcleo central de la placa, cubierto por una capa fibrosa. El término, ateroesclerosis consta de dos partes: aterosis (acumulación de grasa acompañada de diversos macrófagos) y la esclerosis (capa fibrosa compuesta de células del musculo liso, leucocitos y tejido conectivo (Rafieian-Kopaei et al., 2014).
En la actualidad, la ateroesclerosis es una enfermedad común en que los depósitos grasos llamados placas ateromatosas aparecen en las capas internas de las arterias. La formación de estas placas se inicia con el depósito de pequeños cristales de colesterol en la íntima y de su músculo liso subyacente. A continuación, las pacas aumentan con la proliferación de tejido fibroso alrededor del músculo liso y la protuberancia en el interior de las arterias y en consecuencia reducen el flujo sanguíneo. La producción por los fibroblastos y el depósito de calcio en la lesión del tejido conectivo causan esclerosis o endurecimiento de las arterias. Finalmente, la superficie irregular de las arterias resulta en la formación de coágulos y trombosis, que conduce a la obstrucción repentina del flujo sanguíneo (Rafieian-Kopaei et al., 2014).
La trombosis se produce como consecuencia de la ruptura de una capa fibrosa, y este fenómeno catastrófico es muy frecuente en el inflamado y adelgazado sitio de la capa fibrosa en lesiones avanzadas. El adelgazamiento de la capa fibrosa es al parecer debido al continuo flujo y la activación de macrófagos que liberan metaloproteinasas de matriz (MMPs) y otras enzimas proteolíticas en estos sitios. Estas enzimas causan la degradación de la matriz y pueden provocar la formación de trombos y la posterior oclusión de la arteria (Kazemi-Bajestani & Ghayour-Mobarhan, 2013).
Por otra parte, las causas exactas y factores de riesgo de la ateroesclerosis son desconocidos; sin embargo, ciertas condiciones, rasgos o hábitos pueden aumentar el riesgo de desarrollar ateroesclerosis. La mayoría de los factores de riesgo incluyendo el colesterol total y LDL alto, niveles bajos de Lipoproteínas de Alta Densidad (HDL) en la sangre, hipertensión arterial, humo del tabaco, diabetes mellitus, obesidad y el estilo de vida sedentario (Rafieian-Kopaei et al., 2014; Schleicher & Friess, 2007) .
1.2.2 Clasificación histológica y diagnóstico de ateroesclerosis
a) Clasificación histológica
De acuerdo al Comité de Lesiones Vasculares sobre ateroesclerosis de la Asociación América del Corazón (AHA, por sus siglas en inglés) proporcionó una clasificación de las lesiones ateroescleróticas humanas que se correlacionan los tipos de lesiones histológicas y correspondientes síndromes clínicos (Tedgui & Mallat, 2006). Así, la ateroesclerosis se manifiesta histológicamente como lesiones arteriales conocidas como placas, que se han caracterizado ampliamente en seis principales tipos de lesiones que reflejan el inicio, desarrollo y etapas maduras de la enfermedad (Bonomini, Tengattini, Fabiano, Bianchi, & Rezzani, 2008). La clasificación histológica, las lesiones se designan por números romanos, el cual indican la secuencia habitual de la progresión de la lesión (Stary et al., 1995). Las lesiones de tipo I a tipo IV, presentan cambios en la morfología de la lesión que se producen principalmente debido al aumento de la acumulación de lípidos. El ciclo entre la lesión tipo V y VI ilustra cómo las lesiones aumentan en espesor cuando los depósitos trombóticos se forman en sus superficies. Los depósitos trombóticos se pueden formar en varias ocasiones durante diferentes lapsos de tiempo en el mismo lugar y puede ser el principal mecanismo para la oclusión progresiva de las arterias de tamaño mediano (Stary et al., 1995).
b) Diagnóstico
Para la determinación de la presencia de ateroesclerosis, los médicos tienen una amplia gama de pruebas y herramientas para el diagnóstico de la enfermedad, entre las que se encuentran: las tablas de riesgo, examen médico, pruebas diagnósticas (pruebas de sangre,) y biomarcadores séricos de ateroesclerosis (Betriu-Bars & Fernandez-Giraldez, 2012; Ibáñez, Pinero, Orejas, & Badimón, 2007; Lahoz & Mostaza, 2007) .
1.2.3 Epidemiología de las enfermedades cardiovasculares
En el 2013, la Organización Mundial de la Salud (OMS) dio a conocer que las ECV son la principal causa de muerte en todo el mundo. Cada año mueren más personas por ECV que por cualquier otra causa. Las muertes por ECV afectan por igual a ambos sexos, y más del 80% se producen en países de ingresos bajos y medios (Organización Mundial de la Salud, 2013).
Se calcula que en 2012 murieron por esta causa 17,5 millones de personas, lo cual representa un 30% de todas las muertes registradas en el mundo; 7,4 millones (13.2%) de esas muertes se debieron a la cardiopatía isquémica, y 6,7 millones (11.9%) a los accidentes cerebrovasculares (ACV). Asimismo se estima que para el 2030 se presenté una defunción de 23.6 millones de personas por esta enfermedad, sobre todo cardiopatías y ACV, y se prevé que sigan siendo la principal causa de muerte (Organización Mundial de la Salud, 2013).
Otro dato importante por mencionar es que la diabetes aumenta el riesgo de cardiopatía y ACV. Un 50 a 80% de los pacientes diabéticos mueren de enfermedad cardiovascular (principalmente cardiopatía y ACV) (Organización Mundial de la Salud, 2013).
En cuanto a la referencia de México, en 2012, el Instituto Nacional de Estadística y Geografía (INEGI) reportó que la principal causa de muerte en México son las enfermedades del corazón con 109, 309 defunciones, lo que indicó el 18.1% de las fallecimientos a nivel nacional. Dentro de las enfermedades del corazón se encuentran las enfermedades isquémicas del corazón con 74,057 defunciones, lo que representó el 12.2% de las defunciones en México y el resto para las enfermedades del corazón (5.8%). Por otro lado, las ECV se encuentran en sexto lugar a nivel nacional, con una defunción de 31,095 habitantes, lo que reveló el 5.2% de las muertes en México durante ese año (Instituto Nacional de Estadística y Geografía, 2014).
Por otra parte, según los resultados de la ENSANUT 2012, se estima que en México hay 22.4 millones de adultos de 20 años o más que padecen hipertensión arterial, de los cuales únicamente 11.2 millones han sido diagnosticados por un médico. De estos mexicanos que han sido diagnosticados y que están en tratamiento, 5.7 millones presentaron cifras de tensión arterial que pueden considerarse como adecuadas, es decir, mantienen su padecimiento controlado (Gutiérrez et al., 2012).
Finalmente, en Hidalgo, la principal causa de muerte en el 2012, según el INEGI, fueron las enfermedades del corazón con 2,256 defunciones, lo que representó el 20% de las muertes a nivel estatal. La principal causa de muerte de las enfermedades del corazón son las enfermedades isquémicas del corazón con 1,816 muertes, lo que indica el 13.7% de las defunciones. En tanto, las ECV, se encuentran en sexto lugar con un promedio de defunciones de 820, el 6.2% de las muertes en el estado de Hidalgo (Instituto Nacional de Estadística y Geografía, 2014).
1.2.4 Estrés oxidativo y ateroesclerosis
Varios EROs han sugerido que desempeñan un papel central en la fisiología y la fisiopatología vascular, el más importante de los cuales son el anión O2, H2O2, NO, y el ONOO. Aunque el O2 puede afectar a las funciones vasculares, también es fundamental en la generación de otras especies reactivas. Cuando el O2 se produce en concierto con NO, estos rápidamente reaccionan para formar la molécula altamente reactiva el ONOO. El ONOO es un importante mediador de la peroxidación lipídica y la modificación de proteínas incluyendo la oxidación de LDL. En ausencia de inmediatamente accesible de NO, el O2 se convierte rápidamente en H2O2 por la superóxido dismutasa, que luego se convierte en H2O por cualquier catalasa, peroxirredoxinas, o glutatión peroxidasa. El H2O2 también puede reaccionar con metales de transición reducidos, por ejemplo Fe2+, para formar el altamente reactivo OH, o puede ser metabolizado por la mieloperoxidasa para formar ácido hipocloroso (HOCl) (Maxwell et al., 1997; Schleicher & Friess, 2007) .
1.3 Granada (Punica granatum L.)
Es el fruto de un árbol llamado granado, que pertenece a la familia de Punicaceae, es un árbol caducifolio distribuido alrededor del mundo (Dipak, Axay, Manodeep, & Jagdish, 2012). Es uno de los frutos hortícolas importantes y comerciales, que generalmente se adapta al clima mediterráneo (Akbarpour, Hemmati, & Sharifani, 2009), y se presume que se originó en el continente asiático (Bell & Hawthorne, 2008), principalmente en el suroeste de Irán y el norte de Turquía (Ercisli et al., 2011).
1.3.1 Importancia económica
1.3.1.1 Producción de granada
En los últimos años, la producción mundial y el consumo de la granada se han incrementado considerablemente. Actualmente dentro de los países líderes en el cultivo se encuentran: India, Afganistán, Irak, España, Israel y los Estados Unidos de Norteamérica (Basu & Penugonda, 2009) . España es uno de los principales productores del mundo y el mayor exportador europeo (Mackness, Durrington, & Mackness, 1999) de los grandes productores a nivel mundial de granada, a pesar de que tiene diversas regiones en su territorio con las condiciones climáticas óptimas para su cultivo. Los estados con mayor producción de cultivo de granada en ton en los años de 2011, 2012 y 2013 fueron: Oaxaca, Hidalgo y Guanajuato, respectivamente (Sistema de Información Agroalimentaria y Pesquera, 2014).
1.3.1.3 Producción de granada en Hidalgo
Durante el 2014, el Sistema de Información Agroalimentaria y Pesquera (SIAP) reportó datos que muestran que el estado de Hidalgo estuvo dentro de los tres primeros lugares a nivel nacional en producción de granada en ton en los años de 2011, 2012, y 2013. Los municipios del estado de Hidalgo con mayor producción de granada en los años de 2011, 2012 y 2013 son los pertenecientes a la región del Valle del Mezquital, en donde Tasquillo, Chilcuautla y Metztitlán encabezan la producción estatal total (Sistema de Información Agroalimentaria y Pesquera, 2014).
1.3.2 Características generales
Árbol
Es un árbol pequeño caducifolio arbustivo, típicamente crece de 3 a 5 m de altura, con el tronco torcido, madera dura y corteza escamosa de color grisáceo, algunas de las ramas son espinosas, tiene ramilla angulosa, copa extendida y con mucho ramaje (Dipak et al., 2012; Jurenka, 2008; Organización de las Naciones Unidas para la Agricultura, 2006) .
Flores
Se producen en verano donde la lluvia es mínima (Dipak et al., 2012), son solitarias o reunidas en grupos de 2 a 5 al final de las ramas nuevas, grandes, color rojo, lustrosas, acampanadas, sustentadas, con 5-8 pétalos y sépalos con un tamaño de 3 cm (Dipak et al., 2012; Organización de las Naciones Unidas para la Agricultura, 2006) y el cáliz tubular que eventualmente se convierte en el fruto (Figura 1A) (Jurenka, 2008).
Hojas
Tienen un tamaño de 3-7 cm de largo y 2 cm de ancho (Dipak et al., 2012), simples, opuestas, generalmente fasciculadas (Organización de las Naciones Unidas para la Agricultura, 2006), coriáceas brillantes, en forma de lanza y color verde oscuro (Figura 1B) (Dipak et al., 2012).
Fruto
El fruto es una baya grande, piel brillante, gruesa coriácea y globulosa de 10-15 cm de diámetro (Figura 1C) (Organización de las Naciones Unidas para la Agricultura, 2006). La parte comestible del fruto se llama arilo (Figura 1D) forma prismática y constituye el 52% del total de la granada, del cual el 78% corresponde al jugo (Figura 1F) y el 22% a las semillas, estos arilos están cubiertos por una membrana blanca que los separa y protege llamada pericarpio (Figura 1E) (Jurenka, 2008).

Figura 1. Componentes de la Granada. A. Flor; B. Hojas; C. Fruto; D. Arilos; E. Pericarpio y mesocarpio; F. Jugo.
1.3.3 Composición nutricional de la granada
La granada es un fruto nutricionalmente rico, está compuesto por agua y azúcares y bajo en grasas y proteínas, lo que le confiere un bajo contenido calórico (63-78 kcal/100 g). Presenta también una pequeña proporción de fibra alimentaria, localizada fundamentalmente en el piñón (0.3-0.9 g/100 g), es rica en potasio y aporta cantidades considerables de calcio, magnesio, fósforo, hierro y sodio. Además contiene, vitaminas del grupo B, C y niacina (Codex Alimentarius Commission, 2010). Dentro de los ácidos orgánicos se componen de ácido málico y cítrico (García-Viguera & Pérez-Vicente, 2004).
1.3.4 Compuestos bioquímicos y bioactivos de la granada
En la última década, se han generado avances significativos en la dilucidación de los mecanismos farmacológicos de la granada y los componentes individuales responsables de ellos. Los extractos de todas las partes de la fruta como son: la cáscara, raíces y hojas del árbol, además del fruto parecen tener propiedades terapéuticas (Jurenka, 2008).
Investigaciones actuales, apuntan a que los beneficios terapéuticos de la granada son debido a sus compuestos polifenólicos (Arun & Singh, 2012). Entre los que se encuentran son: ácido elágico, ácido galico, elagitaninos (punicalina y punicalagina), flavonoides, antocianidinas (derivados 3-glucósidos y 3,5 diglucósidos de delfinidina, cianidina y pelargonidina), antocianos, flavonoles, ácido clorogénico, ácido cafeico, ácido cumárico, ácido ferúlico, catequinas y lignanos (Bell & Hawthorne, 2008; Colombo, Sangiovanni, & Dell' agli, 2013; García-Viguera & Pérez-Vicente, 2004; Gil, Tomás-Barberán, Hess-Pierce, Holcroft, & Kader, 2000; Gorena, Sepúlveda, & Sáenz, 2010; Karasu et al., 2012; Mena, Gironés-Vilaplana, Moreno, & García-Viguera, 2011; Miguel, Neves, & Antunes, 2010; Nishigaki et al., 2008) .
Los fenoles totales se encuentran en una elevada concentración de 250 mg/100 mL de jugo, comparable a la del vino tinto (valores medios de 203 mg/100 mL) y muy superior a la del té verde (103 mg/100 mL) (García-Viguera & Pérez-Vicente, 2004; Gil et al., 2000). En la Tabla 2 se muestra los componentes y sus constituyentes característicos.
Tabla 2. Componentes de la granada y sus constituyentes característicos
|
Componentes de la planta
|
Constituyentes principales
|
Pericarpio
(piel + arilos) |
Punicalaginas, compuestos fenólicos, ácido gálico y otros ácidos grasos, catequizas, EGCG (epigalocatequin galato), quercetina, rutina, flaconas, flavanonas y antocianidinas |
| Aceite de semillas |
95 % ácido púnico, ácido elágico, ácidos grasos, esteroles |
| Jugo de granada |
Antocianos, glucosa, ácido ascórbico, ácido elágico, ácido gálico, ácido cafeico, catequinas, EGCG, quercetina, rutina, minerales, aminoácidos |
| Extracto de las hojas |
Taninos (punicalina y punicafolina), glicósidos de flavonas, incluido la luteolina y apigenina |
| Extracto de las flores |
Ácido gálico, ácido ursólio, triterpenoides, ácido asiático, ácido maslínico y otros constituyentes sin identificar |
| Extracto de las raíces y corteza |
Taninos (punicalina y punicalagina) y numerosos alcaloides |
Fuente: Jurenka, 2008; Sabbar, Naiman, Tabassum, & Khan, 2010.
La clase y la estructura química específica de cada fenólico ha demostrado contribuir significativamente las propiedades biológicas únicas de la granada y dependen de factores tales como especie, variedad, índice de madurez, las condiciones ambientales y agronómicas (García-Viguera & Pérez-Vicente, 2004; Miguel et al., 2010).
1.3.5 Propiedades de la granada
Existen diversos estudios relacionados con las propiedades que presentan los componentes de la granada. Por su contenido polifenólico, Bell y Hawthorne (2008), Jurenka (2008) y Miguel et al. (2010) han demostrado que el fruto de la granada tiene entre 2 y 3 veces más capacidad antioxidante que el vino tinto o el té verde. Como anticancerígeno, se ha demostrado que inhibe potencialmente la invasión de células cancerígenas prostáticas, induce a la apoptosis, causa ruptura en el ciclo celular e inhibe el crecimiento tumoral (Bell & Hawthorne, 2008; Gorena et al., 2010; Jurenka, 2008) . Como antiinflamatorio, inhibe las enzimas lipo-oxigenasa y ciclo-oxigenasa, que son mediadores proinflamatorios (Arun & Singh, 2012; Gorena et al., 2010; Jurenka, 2008) . También se ha asociado en la prevención y tratamiento de enfermedades cardiovasculares; disminuyendo la absorción de colesterol en sangre, lo que reduce significativamente colesterol total y colesterol HDL (Arun & Singh, 2012; Bell & Hawthorne, 2008; Jurenka, 2008; Miguel et al., 2010) .
Otras propiedades asociadas con el consumo del fruto de la granada son sus propiedades hipoglucemiantes en pacientes con diabetes tipo 2 (Arun & Singh, 2012; Gorena et al., 2010; Jurenka, 2008) . También tiene propiedades antihipertensivas, disminuyendo la presión sistólica en pacientes con hipertensión, inhibiendo la enzima que convierte angiotensina en suero (Jurenka, 2008). Además como remedio en casos de heridas, bronquitis, diarrea e infecciones dérmicas (Dipak et al., 2012), actividad antifúngica, antiviral y antibacteriana (Arun & Singh, 2012; Bell & Hawthorne, 2008; Dipak et al., 2012; Jurenka, 2008; Miguel et al., 2010) .
1.3.5.1 Propiedades terapéuticas de la granada en la diabetes mellitus y ateroesclerosis
En la Tabla 3 se presentan diversos estudios que han demostrando los efectos de las diferentes partes de la granada en la atenuación, prevención y tratamiento de la DM y la ateroesclerosis en estudios in vivo en modelos animales y en ensayos en seres humanos (Althunibat et al., 2010; Bagri, Ali, Aeri, Bhowmik, & Sultana, 2009; Betanzos-Cabrera et al., 2011; Das et al., 2001; Esmaillzadeh, Tahbaz, Gaieni, Alavi-Majd, & Azadbakht, 2006; Rosenblat, Hayek, & Aviram, 2006) utilizando diferentes dosis, tiempo, además determinado diferentes variables y finalmente el efecto obtenido.
1.4 Microencapsulación
La encapsulación se puede definir como una técnica en la cual gotas líquidas, partículas sólidas o gaseosas, son cubiertas con una película polimérica porosa conteniendo sustancias bioactivas (Parra, 2010), como: vitaminas, minerales, ácidos grasos, microorganismos probióticos, proteínas, aminoácidos, polifenoles, fibras, enzimas, olores y sabores (Lupo, González, & Maestro, 2012; Yáñez et al., 2002).
Esta membrana, barrera o película está generalmente hecha de componentes con polímeros para crear un entrecruzamiento con propiedades hidrofóbicas y/o hidrofílicas, con el objetivo de impedir su pérdida y protegerlos de la reacción con otros compuestos presentes en el alimento o para impedir que sufran reacciones de oxidación ocasionados por la luz o el oxígeno (Fuchs et al., 2006; Yáñez et al., 2006).
Hoy en día, la industria alimentaria ha utilizado la microencapsulación en una variedad de sustancias alimentarias, o materiales como: lípidos (aceites esenciale-s), sabores volátiles, bacterias probióticas, lactosuero, nutracéuticos, semillas de frutas como uva, guayaba, papaya, manzana, mora entre otras además de: enzimas, pigmentos vegetales, antioxidantes, componentes de aromas, vitaminas, minerales, leche entre otros alimentos (Parra, 2010 ).
Tabla 3. Estudios de la granada en diabetes mellitus y ateroesclerosis
Estudios
in vivo |
Estado clínico |
Parte de la granada |
Dosis |
Tiempo |
Medición de variables |
Efecto |
Referencia |
|
Humano
|
Pacientes diabéticos tipo
2 |
Jugo de granada |
50 mL/día |
90 días |
*Niveles de: glucosa, colesterol total y triglicéridos.
*Estrés oxidativo en suero
(Niveles séricos de peróxidos de lípidos y sustancias reactivas al ácido tiobarbitúrico (TBARS)). |
*Disminución de los niveles de:
peroxidación lipídica, TBARS y la captación celular de las LDL oxidadas.
Sin cambio:
niveles de glucosa, colesterol y triglicéridos. |
(Rosenblat et al., 2006) |
| Humanos
|
Pacientesdiabéticos tipo
2 con hiperlipidemia |
Jugo de granada concentrado |
40 g/día |
56 días |
Niveles de: colesterol total, LDL, HDL,
triglicéridos.
|
*Disminución:
niveles de colesterol total y colesterol LDL.
*Sin cambios:
niveles de triglicéridos y colesterol HDL. |
(Esmaillzadeh et al., 2006) |
| Ratas Zucker obesas |
Diabéticas
(Inducción de diabetes por estreptozotocina) |
Extracto metanólico de semilla |
300-600 mg/kg/día |
Al final de las 12 horas |
*Niveles de: glucosa. |
*Disminución:
niveles de glucosa. |
(Das et al., 2001) |
| Ratones macho CD-1 |
Diabético y alimentados con dieta alta en grasa
(Inducción de diabetes por estreptozotocina) |
Jugo fresco de granada |
12.5 mL/día |
4 meses |
*Peso corporal *Niveles de: glucosa,
colesterol total y triglicéridos. |
*Disminución:
peso corporal y niveles de glucosa.
*Sin cambio:
niveles de colesterol total y triglicéridos. |
(Betanzos-Cabrera et al., 2011) |
| Ratas albinas Wistar |
Diabéticas
(Inducción de diabetes por estreptozotocina) |
Extractos acuosos de las flores |
250 y 500 mg/kg/día |
21 días |
*Niveles de: glucosa,
colesterol (total, LDL, HDL y VLDL) y triglicéridos. |
*Aumento:
niveles de colesterol HDL.
*Disminución:
niveles de glucosa, colesterol total,
LDL, VLDL y triglicéridos. |
(Bagri et al., 2009) |
| Ratas albinas Wistar |
Diabéticas
(Inducción de diabetes por estreptozotocina) |
Extracto metanólico de la cáscara |
10 y 20
mg/kg/día |
28 días |
*Actividad de las enzimas antioxidantes: catalasa, superóxido dismutasa, glutatión peroxidasa, glutatión-S-transferasa y glutatión reductasa.
*Capacidad antioxidante total del suero y la peroxidación lipídica en el hígado y el riñón. |
*Aumento:
actividad de las enzimas antioxidantes:
catalasa, superóxido dismutasa, glutatión peroxidasa, glutatión-S-transferasa y glutatión reductasa, en el hígado y el riñón y capacidad antioxidante en suero.
*Disminución: peroxidación lipídica en hígado y riñón. |
(Althunibat et al., 2010) |
1.4.1 Métodos de microencapsulación
Existen diversos métodos para la producción de microencapsulado. En general, estos métodos se pueden dividir en: químicos y mecánicos (Parra, 2010).
La selección del método dependerá del tamaño medio de la partícula requerida, las propiedades fisicoquímicas del agente encapsulante, la sustancia a encapsular, las aplicaciones para el material microencapsulado, el mecanismo de liberación deseado y el costo (Yáñez et al., 2002).
En el caso de sabores y aromas, varios métodos han sido desarrollados para encapsularlos y utilizarlos en la industria de alimentos; siendo el secado por aspersión uno de los empleados (Finotelli & Rocha-Leão, 2005).
1.4.1.1 Microencapsulación mediante secado por aspersión
El secado por aspersión es el método más común de encapsulación de ingredientes alimentarios, tales como: vitaminas (C y E), ácido fólico, aromas, orégano, aceite de cardamomo, bacterias probióticas, lípidos, ácido linoléico, aceites vegetales, minerales como hierro, pigmentos de antocianina, leche entre otros alimentos (Parra, 2010). El secado por aspersión es usado en la industria alimentaria por una amplia gama de productos en seco formando partículas en polvo además de ser un método económico y efectivo en la protección de materiales, conservación de nutrimentos, bajo costo de procesamiento y buena estabilidad del producto final (Parra, 2010; Sagar & Suresh, 2010; Yáñez et al., 2002;Yousefi, Emam-Djomeh, & Mousavi, 2011) .
El método se basa en atomizar la solución que va a ser secada en forma de gotas muy finas, en el seno de una corriente de gas caliente que generalmente es aire, donde se forman partículas de geometría esférica, con aspecto de esferillas huecas con un diámetro que oscila entre los 20 y hasta los 200 µm. El aire caliente introducido alcanza una temperatura entre 100 y 200 °C. A pesar de la temperatura relativamente alta del aire, las gotas del líquido atomizado se calientan sólo hasta 40 °C debido a la corta duración del secado (fracciones de segundo), lo que evita la degradación del producto, ya que a pesar del aporte de aire caliente, éste sustrae calor por la vaporización del agua (Parra, 2010).
Una de las grandes ventajas de este proceso, además de su simplicidad, es que es apropiado para alimentos sensibles al calor, ya que el tiempo de exposición entre la gota y el aire caliente a temperaturas elevadas es muy corto entre 5 a 30 segundos, para la formación de la microcápsulas (Parize et al., 2008 ).
1.4.1.1.1 Microencapsulación de jugos mediante secado por aspersión
El secado por aspersión en los jugos es una operación de un solo paso que transforma el líquido en un producto en polvo; lo que facilita el transporte al reducir el peso y también preserva el producto de la degradación bacteriana al disminuir drásticamente la actividad de agua (Aw) y el contenido de humedad (menor al 10%) logrando así aumentar su vida útil (García, González, Ochoa, & Medrano, 2004; Vehring, 2008) .
Con respecto a alimentos como frutas y hortalizas frescas que presentan un contenido de humedad superior al 80% es necesario hacer uso de un método de conservación como el secado para mejorar su estabilidad, reducir el peso de transporte y sobre todo mantener su valor nutricional (Sagar & Suresh, 2010).
2. Justificación
La DM es una enfermedad metabólica caracterizada por hiperglucemia crónica resultado de los defectos en la secreción o acción de la insulina, o ambos (American Diabetes Association, 2014a; Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013;Kerner & Bruckel, 2014) . La hiperglucemia crónica de la diabetes se asocia con complicaciones micro y macrovasculares como la ateroesclerosis (American Diabetes Association, 2014a;Canadian Diabetes Association Clinical Practice Guidelines Expert Committee, 2013) . La DM y la ateroesclerosis son enfermedades crónicas, generalizadas y progresivas, presentando un grave problema de salud pública. Conjuntamente, estas enfermedades se encuentran entre las primeras causas de muerte a nivel mundial y en México.
Por otro lado, se ha establecido que el estrés oxidativo juega un papel importante en el progreso de la DM y sus complicaciones a largo plazo como la ateroesclorosis ( Pan et al., 2010; Pitocco et al., 2013; Tiwari, Pandey, Abidi, & Rizvi, 2013) .
Por lo tanto, una posible alternativa para la prevención y tratamiento de la DM y ateroesclerosis es a través de fuentes naturales. Una de ellas es la granada (Punica granatum L.), un fruto rico en compuestos polifenólicos, que le confieren propiedades terapéuticas a la salud como: antioxidante, hipoglucemiante, antiaterogénico, antihipertensivo, antiinflamatorio, antimicrobiano entre otros (Arun & Singh, 2012; Basu & Penugonda, 2009; Bell & Hawthorne, 2008; Dipak et al., 2012; Gorena et al., 2010; Jurenka, 2008; Miguel et al., 2010) . Sin embargo, no es un fruto que consuma habitualmente la población mexicana y una de las razones, en parte, es quizá porque se dispone durante un periodo corto; por lo que después de su maduración es difícil su conservación y manejo, y que afectan su atención para consumirlo. Igualmente, el consumo en fresco involucra dificultades para pelar el fruto y conlleva a la ingesta esporádica y temporal en guarnición de platillos mexicanos (Álvarez-Cervantes, 2014).
No obstante, la microencapsulación es un método adecuado por el cual los compuestos bioactivos son encapsulados evitando su degradación debido a la luz o al oxígeno y así conservar y/o proteger los compuestos presentes en los alimentos (Fuchs et al., 2006; Parra, 2010;Yáñez et al., 2002) .
Por lo que el objetivo del estudio, es evaluar el efecto de la administración subcrónica de un microencapsulado de jugo de granada roja (Punica granatum L.) en ratones CD-1 con diabetes inducidos con estreptozotocina y alimentados con una dieta aterogénica, y demostrar que es efectivo de conservar sin afectar la actividad biológica y poseer propiedades antioxidantes, hipoglucemiantes, antiaterogénicas y antihipertensivas debido a los compuestos bioactivos presentes en el jugo de granada roja, y de esa forma utilizarse como un producto nutracéutico en la dieta habitual de la población para la prevención y tratamiento de diabetes mellitus y ateroesclerosis.
Finalmente, cabe mencionar que las propiedades del fruto antes citadas se han estudiado en humanos y roedores, a través del consumo y administración de jugo de granada o extractos de las diferentes parte del fruto, pero no así de la administración de un microencapsulado de jugo de granada roja en un modelo experimental de diabetes en ratones CD-1 diabéticos y alimentados con una dieta aterogénica (Anoosh, Mojtaba, & Fatemeh, 2010; Aviram & Rosenblat, 2012; Basu & Penugonda, 2009;Betanzos-Cabrera et al., 2011; Davidson et al., 2009; Liu et al., 2013; Mohan, Waghulde, & Kasture, 2010; Stowe, 2011;Wang, Liu, Mi, & Wang, 2014) .
Pregunta de investigación
¿Cuál será el efecto de la administración subcrónica de un microencapsulado de jugo de granada roja sobre el Índice de Masa Corporal, daños y estrés oxidativo, parámetros bioquímicos (glucosa, colesterol total, HDL, LDL y triglicéridos), presión arterial y en tejidos de aorta, hígado y riñón en ratones CD-1 diabéticos y alimentados con una dieta aterogénica?
3. Objetivos
3.1 Objetivo general
Evaluar el efecto de la administración subcrónica de un microencapsulado de jugo de granada roja (Punica granatum L.) en un modelo experimental de diabetes inducida por estreptozotocina en ratones CD-1 y alimentados con una dieta aterogénica.
3.2 Objetivos específicos
- Obtener un microencapsulado de jugo de granada roja mediante secado por aspersión.
- Determinar cómo influye la administración subcrónica de un microencapsulado de jugo de granada roja en el Índice de Masa Corporal en ratones CD-1 diabéticos y alimentados con una dieta aterogénica.
- Evaluar el efecto antihipertensivo en la administración subcrónica de un microencapsulado de jugo de granada roja sobre los niveles de presión arterial en ratones CD-1 diabéticos y alimentados con una dieta aterogénica mediante un método no invasivo utilizando un pletismógrafo de cola.
- Evaluar el efecto antioxidante en la administración subcrónica de un microencapsulado de jugo de granada roja con diferentes dosis sobre los niveles de daño y estrés oxidativo en ratones CD-1 diabéticos y alimentados con una dieta aterogénica utilizando los métodos de antioxidantes totales (ABTS•+), TBARS, actividad enzimática de glutatión peroxidasa y DPPH•.
- Evaluar el efecto hipoglucemiante y antiaterogénico en la administración subcrónica de un microencapsulado de jugo de granada roja sobre los niveles de glucosa, colesterol total, HDL, LDL y triglicéridos en ratones CD-1 diabéticos y alimentados con una dieta aterogénica utilizando kits enzimáticos comerciales.
- Evaluar el efecto de la administración subcrónica de un microencapsulado de jugo de granada roja en diferentes tejidos realizando un estudio histológico en aorta, hígado y riñón.
4. Hipótesis
4.1 Hipótesis nula
Si la microencapsulación es un método para concentrar y conservar los compuestos polifenólicos del jugo de granada roja entonces no protegerá contra el estrés oxidativo y del incremento de los parámetros bioquímicos (glucosa, colesterol total, LDL y triglicéridos) que se presentan en la diabetes mellitus, además del aumento de la presión arterial presente en la ateroesclerosis.
4.2 Hipótesis alterna
Si la microencapsulación es un método para concentrar y conservar los compuestos polifenólicos del jugo de granada roja entonces protegerá contra el estrés oxidativo y del incremento de los parámetros bioquímicos (glucosa, colesterol total, LDL y triglicéridos) que se presentan en la diabetes mellitus, además del aumento de la presión arterial presente en la ateroesclerosis.
5. Materiales y Métodos
5.1 Tipo de estudio
La presente investigación será de tipo experimental. El estudio experimental se basará cumpliendo con lo estipulado en la Norma Oficial Mexicana: Especificaciones Técnicas para la Producción, Cuidado y Uso de Animales de Laboratorio NOM-062-ZOO-1999 (NORMA Oficial Mexicana NOM-062-ZOO-1999), además del Reglamento de la Ley General de Salud en Materia de Investigación para la Salud dentro de los artículos 121-126 del título séptimo de la investigación que incluye a la utilización de animales de experimentación (Ley General de Salud, 1987). Asimismo, el protocolo de investigación será aprobado por el Comité Institucional Ético para el Cuidado y Uso de los Animales de Laboratorio (CIECUAL) del ICSa de la UAEH.
5.2 Obtención del fruto
Se utilizará granada roja madura de temporada agosto de 2014, la cual fue adquirida en el municipio de Ixmiquilpan, Hidalgo (latitud norte 20° 28’ 55”, longitud oeste 99° 13’ 5”, altitud 2, 660 m). El fruto se lavará y se pelará para obtener los arilos. Una vez obtenidos los arilos, se continuará con el proceso de microencapsulación.
5.3 Elaboración de microencapsulado de jugo de granada roja (MJGR)
El microencapsulado de jugo de granada roja (MJGR) será elaborado mediante la técnica de secado por aspersión por la empresa Granding Internacional SA CV México. Posteriormente, producido el MJGR se procederá a desarrollar la parte experimental con animales de experimentación.
5.4 Animales de experimentación y dieta
Para la presente investigación, se utilizarán en total 80 ratones macho CD-1 entre 25-35 g (7 semanas aproximadamente), los cuales serán adquiridos del Bioterio del ICSa de la UAEH. Los animales seleccionados se mantendrán en condiciones estándar como un ciclo de 12 h/12h luz/oscuridad a temperatura constante (22±2 °C) y humedad (50%). Los ratones macho CD-1 se alimentarán con alimento comercial Harlan Teklad® 18% proteína (Madison, WI, USA) y con agua ad libitum. Cualquier animal aparentemente enfermo y que no sean del Bioterio del ICSA, será excluido del experimento. Además, roedores que por alguna razón, mueran durante el desarrollo del proyecto.
La parte experimental se realizará en dos fases, la primera fase se formarán aleatoriamente 9 grupos de 5 ratones cada uno, en cambio en la segunda fase se integrarán 7 grupos de 5 ratones cada uno. Los grupos en las dos fases experimentales están conformados como sigue:
Primera fase experimental
- Grupo 1 control, sin tratamiento + dieta estándar Harlan Teklad®
- Grupo 2 control + microencapsulado de jugo de granada roja (MJGR) con *dosis efectiva + dieta estándar Harlan Teklad®.
- Grupo 3 control + microencapsulado sin jugo de granada roja (MSJGR) con dosis *efectiva (agentes encapsulantes) + dieta estándar Harlan Teklad®.
- Grupo 4 diabetizado, recibirán STZ (solo una dosis de 150 mg/kg vía intraperitoneal (i.p.)), sin tratamiento + dieta estándar Harlan Teklad®.
- Grupos 5, 6, 7 y 8 diabetizados recibirán STZ (solo una dosis de 150 mg/kg i.p.) + MJGR con 4 dosis diferentes (500, 1000, 1500 y 3000 mg/kg), respectivamente + dieta estándar Harlan Teklad®.
- Grupo 9 diabetizado, recibirán STZ (solo una dosis de 150 mg/kg i.p.) + MSJGR con *dosis efectiva + dieta estándar Harlan Teklad®.
Nota: *La dosis efectiva de MJGR será obtenido de la primera fase experimental.
Segunda fase experimental
- Grupo 1 control positivo hipertenso inducido con L-NAME, sin tratamiento + dieta estándar Harlan Teklad®.
- Grupo 2 aterogénico, alimentados con una dieta aterogénica, sin tratamiento.
- Grupo 3 aterogénico, alimentados con una dieta aterogénica + MJGR con dosis efectiva.
- Grupo 4 aterogénico, alimentados con una dieta aterogénica + MSJGR con dosis efectiva.
- Grupo 5 diabetizado + aterogénico, recibirán STZ (solo una dosis de 150 mg/kg i.p.) y alimentados con una dieta aterogénica, sin tratamiento.
- Grupo 6 diabetizado + aterogénico, recibirán STZ (solo una dosis de 150 mg/kg i.p.) y alimentados con una dieta aterogénica + MJGR con dosis efectiva.
- Grupo 7 diabetizado + aterogénico, recibirán STZ (solo una dosis de 150 mg/kg i.p.) y alimentados con una dieta aterogénica + MSJGR con dosis efectiva.
5.4.1 Inducción de diabetes con estreptozotocina en ratones CD-1
Para el caso de los grupos diabetizados, la inducción de la diabetes se hará por la administración vía intraperitoneal (i.p.) con estreptozotocina en regulador de citratos fresco pH 4.5 0.1 M en una sola dosis de 150 mg/Kg. La confirmación el estado diabético será >200 mg/dL de glucosa en ayunas (Betanzos-Cabrera et al., 2011).
5.4.2 Inducción de ateroesclerosis por dieta en ratones CD-1
La inducción de ateroesclerosis en los grupos aterogénicos, se hará por una dieta aterogénica, para este caso existe desde una dieta establecida y comprobada para inducir ateroesclerosis en ratones. Dicha dieta consiste: 1.25% (peso/peso) de colesterol, 0.5% (peso/peso) de colato de sodio y 15% de grasas saturadas en forma de mantequilla de coco (Shimada et al., 1996).
5.4.3 Inducción de hipertensión arterial por L-NAME en ratones CD-1
La inducción de hipertensión arterial para el grupo hipertenso, se hará por la administración i.p. con L-NAME con dosis de 60 mg/Kg (Ramos, Labat, Carvalho, Martin, & Lopes-Martins, 2006).
5.5 Administración subcrónica de MJGR
En la primera fase experimental, se prepararán y se administrarán 4 dosis diferentes de MJGR (500, 1000, 1500 y 3000 mg/kg), las cuales serán disueltas en 3 mL de agua destilada, respectivamente. La administración de MJGR será diario durante las mañanas por vía intrágastrica utilizando una cánula desde el inicio (tiempo cero) y hasta el final del cuarto mes de tratamiento. Posteriormente, se determinará la dosis efectiva de MJGR y se ejecutará la segunda fase experimental incorporando los grupos aterogénicos y grupos diabetizados + aterogénicos, aparte de los respectivos grupos controles. Asimismo, la administración de MJGR será diario durante todas las mañanas por vía intrágastrica desde el tiempo basal y hasta el término del tratamiento.
Durante este periodo de tiempo, como en la primera fase y segunda fase experimental, se determinará al tiempo basal y cada 30 días durante los 4 meses, el Índice de Masa Corporal (IMC), estrés oxidativo (TBARS), antioxidantes totales (ABTS•+), capacidad antioxidante (DPPH•), actividad enzimática de glutatión peroxidasa, parámetros bioquímicos de glucosa, colesterol (total, HDL y LDL), triglicéridos en suero y presión arterial (únicamente se realizará en la segunda experimental). Por último, al finalizar la segunda fase experimental, los animales de experimentación serán sacrificados y al mismo tiempo se hará la extracción aorta, hígado y riñón para su posterior estudio histopatológico, respectivamente.
5.5.1 Medición de IMC en ratones CD-1
La determinación de IMC en ratones CD-1 será siguiendo la técnica de fisler et al. (1993). El peso corporal y la longitud anal-nasal se registrarán en los animales de experimentación para la realización del cálculo del IMC expresado como (Fisler, Warden, Pace, & Lusis, 1993):
5.5.2 Medición de parámetros en suero y obtención de muestra
La cuantificación de parámetros en suero será: estrés y daño oxidativo por el método de TBARS, capacidad antioxidante por el método de DPPH•, antioxidantes totales (ABTS•+), actividad enzimática de glutatión peroxidasa y parámetros bioquímicos de glucosa, colesterol (total y HDL) y triglicéridos. Todos estos últimos ensayos se determinarán utilizando kits enzimáticos comerciales RANSEL (RANDOX). En cuanto a la determinación de la fracción de colesterol LDL será calculado con la fórmula de Friedewald et al. (1972) (Friedewald, Levy, & Fredrickson, 1972).
5.5.3 Determinación de presión arterial (PA)
Para la determinación de la PA [presión arterial sistólica (PAS) y presión arterial diastólica (PAD)] se utilizará un método no invasivo mediante el empleo de un pletismógrafo de cola (Flores, Infante, Sánchez, Martínez, & Rodríguez, 2002; Flores et al., 2007).
5.5.4 Sacrificio y cortes histológicos
Para el análisis histológico, los animales serán sacrificados por dislocación cervical y se realizará la disección de aorta, hígado y riñón, a la postre se realizará el siguiente procedimiento:
Fijación: Los órganos se fijarán en formol 10% pH 7 durante 3 horas, a temperatura ambiente. Al finalizar este tiempo se realizarán 10 lavados con alcohol al 70% con intervalos de 15 minutos, para eliminar el exceso de fijador. Deshidratación: Mediante este proceso se eliminará el agua de los tejidos, sometiéndolos a una serie gradual de alcoholes de concentración ascendente (50-100%) durante 3 horas. Clarificación: Se obtendrá con un baño de alcohol-xilol por una hora y luego dos horas de xilol absoluto. Impregnación: Se realizará por medio de tres baños de parafina absoluta fundida a 56°C por 3 horas. Inclusión: Se colocará el órgano en un molde de papel definiendo la orientación requerida para el corte, posteriormente se agregará la parafina fundida y se dejará solidificar a temperatura ambiente, finalmente, se colocará en el congelador durante 24 hrs.
Por último, se realizarán los cortes con un grosor de 4 micrómetros utilizando un micrótomo rotatorio. Las muestras serán teñidas con la técnica de Hematoxilina-Eosina y se analizará cada uno de los cortes al microscopio óptico.
5.6 Análisis estadístico
Los resultados se expresarán como la Media ± SD., se realizarán pruebas de Test de Student para la comparación de medias y pruebas de ANOVA seguido de la prueba de Tukey para la comparación de más de dos grupos empleando un paquete estadístico (GraphPad software, 2007, versión 5.0, San Diego California, U.S.A.). Valores de p <0.05 serán considerados como significativos.
6. Resultados esperados
Se espera que el microencapsulado de jugo de granada roja concentre y conserve los compuestos bioactivos del jugo de granada roja sin afectar la actividad biológica y preservar las propiedades terapéuticas del fruto (como: antioxidante, hipoglucemiante, antiaterogénico y antihipertensivo) y de esa forma proteger contra el estrés y daño oxidativo y del incremento de los parámetros bioquímicos (glucosa, colesterol total, LDL y triglicéridos) que se presentan en la diabetes mellitus, además del aumento de la presión arterial presente en la ateroesclerosis.
De ser así, el MJGR podría utilizarse como producto nutracéutico en la prevención y tratamiento de la diabetes mellitus y ateroesclerosis.
Referencias bibliográficas
Akbarpour, V., Hemmati, K., & Sharifani, M. (2009). Physical and Chemical Properties of Pomegranate(Punica granatum L.) Fruit in Maturation Stage.American-Eurasian Journal of Agricultural & Environmental Sciences, 6(4), 411-416.
Althunibat, O. Y., Al-Mustafa, A. H., Tarawneh, K., Khleifat, K. M., Ridzwan, B. H., & Qaralleh, H. N. (2010). Protective role of Punica granatum L. peel extract against oxidative damage in experimental diabetic rats.Process Biochemistry, 45(4), 581-585.
Álvarez-Cervantes, P. (2014). Evaluación de la actividad antibacteriana de un microencapsulado de jugo de granada roja (Punica granatum L.) (Tesis de Licenciatura). Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo.
American Diabetes Association. (2011). Standards of medical care in diabetes 2011. Diabetes Care, 34 Suppl 1, S11-61.
American Diabetes Association. (2014a). Diagnosis and classification of diabetes mellitus. Diabetes Care, 37 Suppl 1, S81-90.
American Diabetes Association. (2014b). Standards of medical care in diabetes 2014. Diabetes Care, 37 Suppl 1, S14-80.
Anoosh, E., Mojtaba, E., & Fatemeh, S. (2010). Study the effect of juice of two variety of pomegranate on decreasing plasma LDL cholesterol. Procedia, Social and Behavioral Sciences, 2(2), 620–623.
Arun, N., & Singh, D. P. (2012). Punica granatum: a review on pharmacological and therapeutic properties. International Journal of Pharmaceutical Sciencies and Research, 3(5), 1240-1245.
Atkinson, M. A., Eisenbarth, G. S., & Michels, A. W. (2014). Type 1 diabetes. Lancet, 383(9911), 69-82.
Aviram, M., & Rosenblat, M. (2012). Pomegranate Protection against Cardiovascular Diseases. Evidence-Based Complementary and Alternative Medicine: eCAM, 2012, 382763.
Bagri, P., Ali, M., Aeri, V., Bhowmik, M., & Sultana, S. (2009). Antidiabetic effect of Punica granatum flowers: Effect on hyperlipidemia, pancreatic cells lipid peroxidation and antioxidant enzymes in experimental diabetes. Food and Chemical Toxicology, 47(1), 50-54.
Basu, A., & Penugonda, K. (2009). Pomegranate juice: a heart-healthy fruit juice. Nutrition Research, 67(1), 49-56.
Bell, C., & Hawthorne, S. (2008). Ellagic acid, pomegranate and prostate cancer: a mini review.The Journal of Pharmacy and Pharmacology, 60(2), 139-144.
Betanzos-Cabrera, G., Guerrero-Solano, J. A., Martínez-Pérez, M. M., Calderón-Ramos, Z. G., Belefant-Miller, H., & Cancino-Diaz, J. C. (2011). Pomegranate juice increases levels of paraoxonase1 (PON1) expression and enzymatic activity in streptozotocin-induced diabetic mice fed with a high-fat diet. Food Research International, 44(5), 1381-1385.
Betriu-Bars, A., & Fernandez-Giraldez, E. (2012). Carotid ultrasound for the early diagnosis of atherosclerosis in chronic kidney disease. Nefrologia, 32(1), 7-11.
Bonomini, F., Tengattini, S., Fabiano, A., Bianchi, R., & Rezzani, R. (2008). Atherosclerosis and oxidative stress. Histology and Histopathology, 23(3), 381-390.
Burton, G. J., & Jauniaux, E. (2011). Oxidative stress.Best Practice & Research. Clinical Obstetrics & Gynaecology, 25(3), 287-299.
Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. (2013). Definition, classification and diagnosis of diabetes, prediabetes and metabolic syndrome. Canadian Journal of Diabetes, 37 Suppl 1, S8-11.
Carrera-Boada, C. A., & Martinez-Moreno, J. M. (2013). Pathophysiology of diabetes mellitus type 2: beyond the duo "insulin resistance-secretion deficit". Nutrición Hospitalaria, 28 Suppl 2, 78-87.
Ceriello, A., & Testa, R. (2009). Antioxidant anti-inflammatory treatment in type 2 diabetes. Diabetes care, 32 Suppl 2, S232-236.
Cernea, S., & Dobreanu, M. (2013). Diabetes and beta cell function: de mechanisms to evaluation and clinical implications. Biochemical Medicine. 23(3), 266-280.
Cnop, M., Welsh, N., Jonas, J. C., Jorns, A., Lenzen, S., & Eizirik, D. L. (2005). Mechanisms of Pancreatic-Cell Death in Type 1 and Type 2 Diabetes: Many Differences, Few Similarities. Diabetes, 54 Suppl 2, S97-107.
Codex Alimentarius Commission. (2010). Joint FAO/WHO food standards programme. Recuperado el 18 de noviembre de 2012, de www.codexalimentarius.org/download/report/731/al33_35s.pdf.
Colombo, E., Sangiovanni, E., & Dell'agli, M. (2013). A review on the anti-inflammatory activity of pomegranate in the gastrointestinal tract. Evidence-Based Complementary and Alternative Medicine: eCAM, 2013, 247145.
Chaturvedi, N. (2007). The burden of diabetes and its complications: trends and implications for intervention. Diabetes Research and Clinical Practice, 76 Suppl 1, S3-12.
Das, A. K., Mandal, S. C., Banerjee, S. K., Sinha, S., Saha, B. P., & Pal, M. (2001). Studies on the hypoglycaemic activity of Punica granatum seed in streptozotocin induced diabetic rats. Phytotherapy Research: PTR, 15(7), 628-629.
Davidson, M. H., Maki, K. C., Dicklin, M. R., Feinstein, S. B., Witchger, M., Bell, M., . . . Aviram, M. (2009). Effects of consumption of pomegranate juice on carotid intima-media thickness in men and women at moderate risk for coronary heart disease. The American Journal of Cardiology, 104(7), 936-942.
Dipak, G., Axay, P., Manodeep, C., & Jagdish, K. V. (2012). Phytochemical and pharmacological profile of Punica granatum: an overview. International Research Journal of Pharmacy, 3(2), 65-68.
Eizirik, D. L., Colli, M. L., & Ortis, F. (2009). The role of inflammation in insulitis and beta-cell loss in type 1 diabetes. Nature Reviews Endocrinology, 5(4), 219-226.
Ercisli, S., Kafkas, E., Orhan, E., Kafkas, E., Dogan, Y., & Esitken, A. (2011). Genetic characterization of pomegranate (Punica granatum L.) genotypes by AFLP markers. Biological Research, 44(4), 345-350.
Esmaillzadeh, A., Tahbaz, F., Gaieni, I., Alavi-Majd, H., & Azadbakht, L. (2006). Cholesterol-lowering effect of concentrated pomegranate juice consumption in type II diabetic patients with hyperlipidemia. International Journal for Vitamin and Nutrition Research, 76(3), 147-151.
Finotelli, P. V., & Rocha-Leão, M. H. M. (2005). Microencapsulation of ascorbic acid in maltodextrin and Capsul using Spray-Drying. In 2nd Mercosur Congress on Chemical Engineering, 4th Mercosur Congress on Process System Engineering (pp. 1-11).
Fiorentino, T. V., Prioletta, A., Zuo, P., & Folli, F. (2013). Hyperglycemia-induced oxidative stress and its role in diabetes mellitus related cardiovascular diseases. Current Pharmaceutical Design, 19(32), 5695-5703.
Fisler, J. S., Warden, C. H., Pace, M. J., & Lusis, A. J. (1993). BSB: a new mouse model of multigenic obesity. Obesity Research, 1(4), 271-280.
Flores, C. L. P., Infante, V. O., Sánchez, T. G., Martínez, M. R., & Rodríguez, R. G. (2002). Detección de signos vitales en ratas mediante métodos no invasivos. Veterinaria México, 33(2), 179-187.
Flores, C. P. L., Santos, M. L. E., Martínez, M. R., Cortés, T. S., Sánchez, T. G., & Infante, V. O. (2007). Confiabilidad de la presión arterial sistémica determinada por un método no invasivo en ratas normotensas. Revista del Instituto Nacional de Enfermedades Respiratorias, 20(4), 247-254.
Friedewald, W. T., Levy, R. I., & Fredrickson, D. S. (1972). Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clinical Chemistry, 18(6), 499-502.
Frostegard, J. (2013). Immunity, atherosclerosis and cardiovascular disease. BMC Medicine, 11(1), 1-12.
Fuchs, M., Turchiuli, C., Bohin, M., Cuvelier, M. E., Ordonnaud, C., Peyrat-Maillard, M. N., & Dumoulin, E. (2006). Encapsulation of oil in powder using spray drying and fluidised bed agglomeration. Journal of Food Engineering, 75(1), 27-35.
Gan, M. J., Albanese-O'Neill, A., & Haller, M. J. (2012). Type 1 diabetes: current concepts in epidemiology, pathophysiology, clinical care, and research. Current Problems in Pediatric and Adolescent Health Care, 42(10), 269-291.
García-Viguera, C., & Pérez-Vicente, A. (2004). La granada. Alimento rico en polifenoles antioxidantes y bajo en calorías. Alimentación Nutrición y Salud, 11(4), 113-120.
García, G. C., González, M. M. B., Ochoa, M. L. A., & Medrano, R. H. (2004). Microencapsulación de jugo de cebada verde mediante secado por aspersión. Ciencia y Tecnología Alimentaria, 4(4), 262-266.
Giacco, F., & Brownlee, M. (2010). Oxidative stress and diabetic complications. Circulation Research, 107(9), 1058-1070.
Gil, M. I., Tomás-Barberán, F. A., Hess-Pierce, B., Holcroft, D. M., & Kader, A. A. (2000). Antioxidant activity of pomegranate juice and its relationship with phenolic composition and processing. Journal of Agricultural and Food Chemistry, 48(10), 4581-4589.
Gorena, T., Sepúlveda, E., & Sáenz, C. (2010). Compuestos bioactivos y actividad antioxidante de frutos de granado (Punica granatum). La alimentación latinoaméricana (285), 48-52.
Gutiérrez, J. P., Rivera-Dommarco, J., Shamah-Levy, T., Villalpando-Hernández, S., Franco, A., Cuevas-Nasu, L., . . . Hernández-Ávila, M. (2012). Encuesta Nacional de Salud y Nutrición 2012. Resultados Nacionales. En Instituto Nacional de Salud Pública (Ed.), Encuesta Nacional de Salud y Nutrición 2012(pp. 108-116). Recuperado de:
Link de acceso
Henriksen, E. J., Diamond-Stanic, M. K., & Marchionne, E. M. (2011). Oxidative stress and the etiology of insulin resistance and type 2 diabetes. Free Radical Biology & Medicine, 51(5), 993-999.
Ibáñez, B., Pinero, A., Orejas, M., & Badimón, J. J. (2007). Novel Imaging Techniques for Quantifying Overall Atherosclerotic Burden. Revista Española de Cardiología, 60(3), 299-309.
In't Veld, P. (2011). Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets, 3(4), 131-138.
Instituto Nacional de Estadística y Geografía. (2014). Estadísticas de Mortalidad. Recuperado el 23 de septiembre de 2014, de: Link de acceso.
Instituto Nacional de Salud Pública. (2013). Encuesta Nacional de Salud y Nutrición 2012. Resultados por entidad federativa, Hidalgo. En Instituto Nacional de Salud Pública (Ed.), Encuesta Nacional de Salud y Nutrición 2012 (pp. 108-116). Recuperado de
http://www.insp.mx/produccion-editorial/novedades-editoriales/3057-ensanut2012-resultados-entidad-federativa.html
International Diabetes Federation. (2013). IDF Diabetes Atlas. Recuperado el 14 de agosto de 2014, de http://www.idf.org/diabetesatlas.
Johnson, J. D., & Luciani, D. S. (2010). Mechanisms of pancreatic beta-cell apoptosis in diabetes and its therapies. Advances in Experimental Medicine and Biology, 654, 447-462.
Jurenka, J. S. (2008). Therapeutic applications of pomegranate (Punica granatum L.): a review. Alternative Medicine Review: a Journal of Clinical Therapeutic, 13(2), 128-144.
Kahn, S. E., Cooper, M. E., & Del Prato, S. (2014). Pathophysiology and treatment of type 2 diabetes: perspectives on the past, present, and future. Lancet, 383(9922), 1068-1083.
Karasu, C., Cumaoglu, A., Gurpinar, A. R., Kartal, M., Kovacikova, L., Milackova, I., & Stefek, M. (2012). Aldose reductase inhibitory activity and antioxidant capacity of pomegranate extracts. Interdisciplinary Toxicology, 5(1), 15-20.
Kazemi-Bajestani, S. M. R., & Ghayour-Mobarhan, M. (2013). Concept of Atherosclerosis Velocity: Is It a Better Measure of Cardiovascular Risk?. Iranian Journal of Medical Sciences, 38(3), 210–220.
Kerner, W., & Bruckel, J. (2014). Definition, classification and diagnosis of diabetes mellitus. Experimental and Clinical Endocrinology & Diabetes, 122(7), 384-386.
Lahoz, C., & Mostaza, J. M. (2007). Atherosclerosis as a systemic disease. Revista Española de Cardiología, 60(2), 184-195.
Lenzen, S. (2008a). The mechanisms of alloxan- and streptozotocin-induced diabetes. Diabetologia, 51(2), 216-226.
Lenzen, S. (2008b). Oxidative stress: the vulnerable beta-cell.Biochemical Society transactions, 36(Pt 3), 343-347.
Ley General de Salud. (1987). Reglamento de la ley General de Salud en Materia de Investigación para la Salud. Recuperado el 06 de noviembre de 2014, de http://www.salud.gob.mx/unidades/cdi/nom/compi/rlgsmis.html.
Liu, K., Xing, A., Chen, K., Wang, B., Zhou, R., Chen, S., . . . Mi, M. (2013). Effect of fruit juice on cholesterol and blood pressure in adults: a meta-analysis of 19 randomized controlled trials. PLoS One, 8(4), e61420.
Lupi, R., & Del Prato, S. (2008). Beta-cell apoptosis in type 2 diabetes: quantitative and functional consequences. Diabetes & Metabolism, 34 Suppl 2, S56-64.
Lupo, P. B., González, A. C., & Maestro, G. A. (2012). Microencapsulación con alginato en alimentos. Técnicas y aplicaciones. Revista Venezolana de Ciencia y Tecnología de Alimentos, 3(1), 130-151.
Mackness, B., Durrington, P. N., & Mackness, M. I. (1999). Polymorphisms of paraoxonase genes and low-density lipoprotein lipid peroxidation. Lancet, 353(9151), 468-469.
Mangge, H., Becker, K., Fuchs, D., & Gostner, J. M. (2014). Antioxidants, inflammation and cardiovascular disease. World Journal of Cardiology, 6(6), 462-477.
Maxwell, S. R. J., Thomason, H., Sandler, D., LeGuen, C., Baxter, M. A., Thorpe, G. H. G., . . . Barnett, A. H. (1997). Poor glycaemic control is associated with reduced serum free radical scavenging (antioxidant) activity in non-insulin-dependent diabetes mellitus. Annals of Clinical Biochemistry, 34(6), 638-644.
Melloul, D. (2008). Role of NF-kappaB in beta-cell death. Biochemical Society transactions, 36(Pt 3), 334-339.
Mena, P., Gironés-Vilaplana, A., Moreno, D. A., & García-Viguera, C. (2011). Pomegranate Fruit for Health Promotion: Myths and Realities. Functional Plant Science and Biotechnology, 5(2), 33-42.
Miguel, M. G., Neves, M. A., & Antunes, M. D. (2010). Pomegranate (Punica granatum L.): A medicinal plant with myriad biological properties -a short review. Journal of Medicinal Plant Research, 4(25), 2836-2847.
Mohan, M., Waghulde, H., & Kasture, S. (2010). Effect of pomegranate juice on Angiotensin II-induced hypertension in diabetic Wistar rats. Phytotherapy Research: PTR, 24 Suppl 2, S196-203.
Nishigaki, I., Rajendran, P., Venugopal, R., Ekambaram, G., Sakthisekaran, D., & Nishigaki, Y. (2008). Effect of Extract of Pomegranate (Glycated Protein-iron Chelate-induced Toxicity: An In Vitro Study on Human Umbilical-vein Endothelial Cells. Journal of Health Science, 54(4), 441-449.
Nolan, C. J., Damm, P., & Prentki, M. (2011). Type 2 diabetes across generations: de pathophysiology to prevention and management. Lancet, 378(9786), 169-181.
NORMA Oficial Mexicana NOM-062-ZOO-1999. (2001). Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio. Recuperado de:
Link de acceso
Ogbera, A. (2014). Pathophysiology of Type 1 diabetes mellitus. Diabetes Research and Clinical Practice, 103, S4.
Organización de las Naciones Unidas para la Agricultura. (2006). Fichas técnicas productos frescos y procesados. Recuperado el 30 de septiembre de 2012, de
Link de acceso .
Organización Mundial de la Salud. (2013). Enfermedades cardiovasculares. Recuperado el 22 de septiembre de 2014, de
http://www.who.int/mediacentre/factsheets/fs317/es/.
Pan, H. Z., Zhang, L., Guo, M. Y., Sui, H., Li, H., Wu, W. H., . . . Chang, D. (2010). The oxidative stress status in diabetes mellitus and diabetic nephropathy.Acta Diabetologica, 47 Suppl 1, 71-76.
Parize, A. L., de Souza, T. C. R., Brighente, I. M. C., de Fevere, V. T., Laranjeira, M. C. M., Spinelli, A., & Longo, E. (2008). Microencapsulation of the natural urucum pigment with chitosan by spray drying in different solvents.African Journal of Biotechnology, 7(17), 3107-3114.
Parra, R. A. H. (2010). Revisión: Microencapsulación de Alimentos. Revista Facultad Nacional de Agronomía, 63(2), 5669-5684.
Pitocco, D., Tesauro, M., Alessandro, R., Ghirlanda, G., & Cardillo, C. (2013). Oxidative stress in diabetes: implications for vascular and other complications. International Journal of Molecular Sciences, 14(11), 21525-21550.
Rafieian-Kopaei, M., Setorki, M., Doudi, M., Baradaran, A., & Nasri, H. (2014). Atherosclerosis: Process, Indicators, Risk Factors and New Hopes. International Journal of Preventive Medicine, 5(8), 927-946.
Rains, J. L., & Jain, S. K. (2011). Oxidative stress, insulin signaling, and diabetes. Free Radical
Ramos, L., Labat, R., Carvalho, F. A. S., Martin, A. B., & Lopes-Martins, R. Á. B. (2006). Effect of oral arginine administration over blood pressure and cardiac parameters in rats submitted to chronic inhibition of nitric oxide synthesis.Revista Brasileira de Medicina do Esporte, 12(4), 169-174.
Raza, H., & John, A. (2012). Streptozotocin-induced cytotoxicity, oxidative stress and mitochondrial dysfunction in human hepatoma HepG2 cells. International Journal of Molecular Sciences, 13(5), 5751-5767.
Rees, D. A., & Alcolado, J. C. (2005). Animal models of diabetes mellitus. Diabetic medicine, 22(4), 359-370.
Robertson, R. P., Zhou, H. R., Zhang, T., & Harmon, J. S. (2007). Chronic oxidative stress as a mechanism for glucose toxicity of the beta cell in type 2 diabetes. Cell Biochemistry and Biophysics, 48(2-3), 139-146.
Rosenblat, M., Hayek, T., & Aviram, M. (2006). Anti-oxidative effects of pomegranate juice (PJ) consumption by diabetic patients on serum and on macrophages. Atherosclerosis, 187(2), 363-371.
Sabbar, D. S., Naiman, A. M., Tabassum, H., & Khan, M. (2010). Studies on Antibacterial and Antifungal Activity of Pomegranate (Punica granatum L.). American-Eurasian Journal of Agricultural & Environmental Sciences, 9(3), 273-281.
Sagar, V. R., & Suresh, K. P. (2010). Recent advances in drying and dehydration of fruits and vegetables: a review. Journal of Food Science and Technology, 47(1), 15–26.
Schleicher, E., & Friess, U. (2007). Oxidative stress, AGE, and atherosclerosis. Kidney International Supplement, 72 Suppl 1, S17-26.
Shimada, M., Ishibashi, S., Inaba, T., Yagyu, H., Harada, K., Osuga, J. I., . . . Yamada, N. (1996). Suppression of diet-induced atherosclerosis in low density lipoprotein receptor knockout mice overxpressing lipoprotein lipase. Proceedings of the National Academy of Sciences of the United States of America, 93(14), 7242-7246.
Sistema de Información Agroalimentaria y Pesquera. (2014). Producción anual. Recuperado el 26 de septiembre de 2014, de :
Link de acceso.
Smirnov, A. V., Snigur, G. L., & Voronkova, M. P. (2012). Pancreatic Islet Beta-Cell Apoptosis in Experimental Diabetes Mellitus. Ntuli, T. (Ed.), Apoptosis and Medicine (pp. 226-246). Recuperado de:
Link de acceso
Smushkin, G., & Vella, A. (2010). What is type 2 diabetes?. Medicine, 38(11), 597-601.
Stary, H. C., Chandler, A. B., Dinsmore, R. E., Fuster, V., Glagov, S., Insull, W. Jr., . . . Wissler, R. W. (1995). A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis. A report de the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Circulation, 95(5), 1355-1374.
Stowe, C. B. (2011). The effects of pomegranate juice consumption on blood pressure and cardiovascular health. Complementary Therapies in Clinical Practice, 17(2), 113-115.
Styskal, J., Van Remmen, H., Richardson, A., & Salmon, A. B. (2012). Oxidative stress and diabetes: what can we learn about insulin resistance de antioxidant mutant mouse models?. Free Radical Biology & Medicine, 52(1), 46-58.
Szabo, C. (2009). Role of nitrosative stress in the pathogenesis of diabetic vascular dysfunction. British Journal of Pharmacology, 156(5), 713-727.
Szkudelski, T. (2001). The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas. Physiological Research, 50(6), 537-546.
Tanaka, S., Aida, K., Nishida, Y., & Kobayashi, T. (2013). Pathophysiological mechanisms involving aggressive islet cell destruction in fulminant type 1 diabetes. Endocrine Journal, 60(7), 837-845.
Tedgui, A., & Mallat, Z. (2006). Cytokines in atherosclerosis: pathogenic and regulatory pathways. Physiological Reviews, 86(2), 515-581.
Thrower, S. L., & Bingley, P. J. (2010). What is type 1 diabetes?. Medicine, 38(11), 592-596.
Tiwari, B. K., Pandey, K. B., Abidi, A. B., & Rizvi, S. I. (2013). Markers of Oxidative Stress during Diabetes Mellitus. Journal of Biomarkers, 2013, 1-8.
Vehring, R. (2008). Pharmaceutical particle engineering via spray drying. Pharmaceutical Research, 25(5), 999-1022.
Wang, B., Liu, K., Mi, M., & Wang, J. (2014). Effect of fruit juice on glucose control and insulin sensitivity in adults: a meta-analysis of 12 randomized controlled trials. PLoS One, 9(4), e95323.
Wang, C., Guan, Y., & Yang, J. (2010). Cytokines in the Progression of Pancreatic beta-Cell Dysfunction. International Journal of Endocrinology, 2010, 515136.
Weber, C., & Noels, H. (2011). Atherosclerosis: current pathogenesis and therapeutic options. Nature Medicine, 17(11), 1410-1422.
Whiting, D. R., Guariguata, L., Weil, C., & Shaw, J. (2011). IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030.Diabetes Research and Clinical Practice, 94(3), 311-321.
Yan, L. J. (2014). Pathogenesis of chronic hyperglycemia: de reductive stress to oxidative stress. Journal of Diabetes Research, 2014, 137919.
Yáñez, J. F., Salazar, J. A. M., Chaires, L. M., Jiménez, J. H., Márquez, M. R., & Ramos, E. G. R. (2002). Aplicaciones biotecnológicas de la microencapsulación. Industria Alimentaria, 28(1), 10-12.
Yáñez, J. F., Salazar, J. A. M., Chaires, L. M., Jiménez, J. H., Márquez, M. R., & Ramos, E. G. R. (2006). Aplicaciones Biotecnológicas de la Microencapsulación. Industria Alimentaria, 21(28), 10-16.
Yousefi, S., Emam-Djomeh, Z., & Mousavi, S. M. (2011). Effect of carrier type and spray drying on the physicochemical properties of powdered and reconstituted pomegranate juice (Punica Granatum L.). Journal of food Science and Technology, 48(6), 677-684.
Zatalia, S. R., & Sanusi, H. (2013). The role of antioxidants in the pathophysiology, complications, and management of diabetes mellitus.Acta Medica Indonesiana, 45(2), 141-147.
[a] Profesor Investigador del Área Académica de Nutrición, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo, México.
[b] Profesor Investigador del Área Académica de Medicina, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo, México
[c] Alumno de la Maestría en Ciencias Biomédicas y de la Salud, Área Académica de Medicina, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo, México.
Autor de correspondencia: E-mail: alvarezcervantes_pedro@hotmail.com