Las nanoesferas de oro presentan ventajas como agentes fototerapéuticos en el tratamiento de cáncer, transporte y vectorización selectiva de fármacos y macromoléculas terapéuticas. En este proyecto se presenta la farmacocinética de nuevos nanofármacos (AuNPs y AuNPs-LAN) utilizando la metodología analítica reportada de su caracterización in vitro (Molina-Trinidad y cols.) para determinar la posología de estos compuestos útiles en el diagnóstico y en el tratamiento de cáncer, utilizando un programa de ajuste no lineal (WinNonlin). Las AuNPs se ajustan a un modelo abierto de dos compartimientos (MADC) y el AuNPs-LAN se ajusta a un modelo independiente de infusión continua. Los parámetros farmacocinéticos obtenidos para las AuNPs fueron (ke=0.020 ± 0.0016 min-1); (ABC0∞=1367 ± 107.3 µg/mL*min); (Vd=69.49 ± 0.113 mL en estado estacionario); (t1/2=254 ± 81 min); (CL=0.119 mL/min ± 0.0098 mL/min) (MRT=380.7 ± 150 min). Para el conjugado AuNPs-LAN; ( λ= 0.328 ± 0.072 min-1); (t1/2= 2.3 ± 0.269 h); (ABC0∞=9720 ± 1330 µ/mL*min); (Vd=1.625 ± 0.182 mL); (CL=0.527 ± 0.083 mL/min); (MRT=66.91 ± 8.162 min). Se concluye que los parámetros farmacocinéticos son útiles en estudios posteriores (fases preclínica y clínica).
Palabras clave: Farmacocinética, nanoesferas, nanopartículas, AuNPs, AuNPs-LAN.
Gold nanospheres have advantages as phototherapeutic in cancer treatment, transportation and selective vectoring macromolecules drugs and therapeutic agents. In this project we present nanodrugs pharmacokinetics (AuNPs and AuNPs-LAN) using the analytical method reported in vitro of characterization (Molina-Trinidad, et al.) To determine the dosage of these compounds useful in the diagnosis and treatment cancer, we used a nonlinear fitting program (WinNonlin). The AuNPs follow a two compartment open model (MADC) and AuNPs-LAN conforms to an independent continuous infusion model fit. Pharmacokinetic parameters were obtained for AuNPs (ke = 0.020 ± 0.0016 min-1); (AUC0∞ = 1367 ± 107.3 mg / mL* min); (Vd = 69.49 ± 0.113 mL at steady state); (t1/2 = 254 ± 81 min); (CL = 0.119 mL / min ± 0.0098 mL / min) (MRT = 380.7 ± 150 min). For the conjugated AuNPs-LAN; (λ= 0.328 ± 0.072 min-1); (t1/2 = 2.3 ± 0.0269 h); (AUC0∞ = 9720 ± 1330 μg/ mL *min); (Vd = 1.625 ± 0.182 mL); (CL = 0.527 ± 0.083 mL / min); (MRT = 66.91 ± 8.162 min). It was concluded that pharmacokinetic parameters are useful in subsequent studies (preclinical and clinical phases).
Keywords: Pharmacokinetic, nanospheres, nanoparticles, AuNPs, AuNPs-LAN.
En el área de la Salud la Nanotecnología ha adquirido importancia, actualmente el uso de sistemas nanoestructurados en la aplicación biomédica permite explorar diferentes campos los cuales eran desconocidos como es el caso del cáncer. Las nanopartículas ya se utilizaban en siglos pasados, ya que, por sus propiedades ópticas y medicinales eran fácilmente detectadas.
El uso de oro con fines médicos se conoce desde el año 2500 A.C. utilizado como oro coloidal en China. En el siglo XVI el oro fue utilizado en el tratamiento de epilepsia y en el siglo XIX era el fármaco de elección en la terapia de la sífilis (Roa et al., 2004).
El descubrimiento por Robert Koch del efecto bacteriostático del cianuro de oro frente al bacilo de la tuberculosis, marca el comienzo de su uso en la medicina, introduciéndose en la terapia de la tuberculosis en 1920. Una de las indicaciones actuales importantes del oro es en el tratamiento de la artritis reumatoide y otras enfermedades reumáticas, incluyendo psoriasis y lupus eritematoso. En el tratamiento de la artritis reumatoide en principio se utilizaron tiolatos (tiomalato, tioglucosa…) de oro que eran administrados intramuscularmente en forma de solución. Pero estos compuestos, que experimentaban una rápida biodistribución a órganos como el riñón, hígado y bazo, no estaban exentos de poder causar desórdenes sanguíneos así como nefro- y hepatotoxicidad. Por este motivo se introdujo en 1985 una segunda generación de fármacos de oro conteniendo ligandos fosfina, permitiendo su permanencia más tiempo en circulación, reduciéndose de manera significativa la nefrotoxicidad. Las AuNPs presentan una baja toxicidad y una de sus propiedades es que pueden ser modificadas mediante su funcionalización con múltiples ligandos, con la finalidad de obtener nanosistemas óptimos para las distintas aplicaciones terapéuticas. Actualmente las nanopartículas metálicas son coloides utilizados en el tratamiento de enfermedades geriátricas (Daniel & Astruc, 2004).
Uno de los objetivos primordiales del desarrollo y diseño de fármacos es producir sistemas que tengan características fisicoquímicas que permitan su ingreso en el organismo sin alterar las funciones bioquímicas del mismo con el fin de llegar a un sitio específico que permita realizar su función para dar lugar a una respuesta farmacológica traducido en un efecto inmediato o prolongado.
Actualmente la funcionalización de sistemas nanoestructurados con fines médicos puede ser una alternativa de diagnóstico y terapia para tratamientos de enfermedades crónico degenerativas, ya que existe una amplia información respecto a las ventajas que presentan los métodos espectroscópicos utilizados para cuantificar y caracterizar sistemas nanoestructurados en México y en colaboración con investigadores de Cuba en México. Desde el 2010 se ha desarrollado este nuevo sistema farmacéutico (core Shell) que se pretende sirva para el diagnóstico y terapia de cáncer (Molina-Trinidad et al., 2010; Molina-Trinidad et al., 2011).
En esta Universidad tras un estudio exhaustivo y con antecedentes confiables se ha desarrollado la metodología analítica que nos permita cuantificar las nanoesferas de oro unidas a un péptido derivado de la somatostatina en estudios in vitro e in vivo en la fase preclínica de la investigación. A la fecha ya existen publicaciones que indican el método analítico para cuantificar las nanopartículas de oro y de su caracterización in vitro (Molina-Trinidad et al., 2011; Molina-Trinidad et al., 2014; Molina-Trinidad et al., 2015).
Hoy en día se han realizado estudios in vitro de biodistribución y de depuración de las nanoesferas en ratas Wistar. Se espera completar este estudio a futuro para determinar la farmacocinética de las nanoesferas y permitir su aplicación en el ámbito clínico.
Para lograr los objetivos planteados en este proyecto referidos a la funcionalización de nanopartículas de oro y su conjugado lanreótido como sistemas de liberación in vitro, se partirá de la metodología reportada anteriormente respecto a la caracterización y cuantificación del nanofármacos in vitro. La hipótesis de investigación va dirigida al desarrollo de nuevos sistemas nanoestructurados que permitan la internalización dirigida en células específicas, es decir, la selectividad específica considerando dosis pequeñas de administración de las nanoesferas en investigación para permitir un ajuste de dosis personalizado.
La metodología utilizada para la validación y cuantificación de las nanoesferas in vitro e in vivo es la referida a la espectrofotometría UV-vis y por electroforesis capilar.
Los resultados obtenidos respecto a la caracterización y metodología analítica ya han sido reportados en diferentes publicaciones y en este trabajo se reportan la farmacocinética del nanofármaco in vitro utilizando el software WinNonlin.
Conocer la Farmacocinética de las nanoestructuras del AuNPs y del conjugado AuNPs-LAN nos permitirá inferir respecto a la posología adecuada para uso en tratamientos de cáncer y posiblemente nos permita diseñar nuevos sistemas de contraste para uso diagnóstico.
Debido a las ventajas que presentan las AuNPs como la capacidad para atravesar las barreras biológicas: piel, mucosa gastrointestinal, mucosa respiratoria y la barrera hematoencefálica para alcanzar el órgano, tejido o grupo celular diana donde la molécula debe ejercer su acción, las nanopartículas pueden permitirnos alcanzar compartimentos intracelulares controlando la liberación de la molécula activa en su lugar de acción o absorción. Por lo anterior es necesario determinar y analizar los parámetros farmacocinéticos in vitro, para que posteriormente con los datos obtenidos diseñar estudios en la fase preclínica y poder escalar en la fase clínica con el fin de realizar ajuste de dosis en la práctica oncológica y en el diagnóstico molecular en relación a su uso como medio de contraste o como biomarcadores para estudios de resonancia magnética para la detección temprana de tumores y como parte del desarrollo de fármacos antineoplásicos.
¿Qué modelos permitirán conocer el comportamiento de las nanoesferas de oro (AuNPs) y del conjugado (AuNPs-LAN) en el organismo, traducidos a la respuesta farmacocinética y a la determinación de los parámetros farmacocinéticos obtenidos por simulación in vitro?
Determinación de farmacocinética de las nanoesferas de oro (AuNPs) y del conjugado (AuNPs-LAN).
Determinación de los parámetros farmacocinéticos de las nanoesferas de oro (AuNPs) y del conjugado (AuNPs-LAN) mediante un sistema de simulación in vitro.
El periodo de estudio fue de 12 meses, para las simulaciones in vitro de nanoparticulas de oro y para el conjugado lanreotido (AuNPs y AuNPS-LAN) donde se utilizó agua desionizada para realizar las simulaciones y para cada una de ellas se utilizaron 5 litros de agua respectivamente.
Simulación in vitro de las nanopartículas de oro (AuNPs) y del conjugado lanreótido (AuNPs- LAN), siguiendo el modelo abierto de dos compartimientos bolo i.v, dosis única.
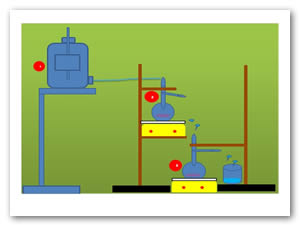
1. Se colocó una botella de mariotte con 5 lts de agua a una altura de 1 m, posteriormente se colocó un matraz de vástago de 500 ml sobre la parrilla magnética a una altura de 50 cm. Después se colocó otro matraz de 500 ml de fondo plano con vástago sobre otra parrilla magnética en la mesa.
2.Se dejó fluir el agua de la botella de mariotte de modo que el flujo se ajustara a 25 ml por minuto, utilizando un sistema de venoclisis.
3.De una solución preparada de nanopartículas de oro (AuNPs) o del conjugado lanreótido (AuNPs) se tomaron 15 ml de la solución y se virtieron en un matraz de vástago y se homogenizó la solución con agua desionizada.
4.Se procedió a correr el flujo con la solución de AuNPs y se comenzó a tomar muestras en tubos de ensaye, la primera muestra se monitoreo a los 5 minutos después de haber corrido el flujo, y posteriormente cada diez minutos hasta 100 o 120 minutos para seguir el comportamiento farmacocinético de los sistemas nanoestructurados. La respuesta en unidades de absorbancia fue obtenida a una longitud de onda, λ= 523 nm.
5.De la solución monitoreada correspondiente al tiempo final se tomó una muestra para determinar la absorbancia correspondiente.
La siguiente figura representa la simulación del modelo abierto de dos compartimientos (MADC) in vitro utilizando una botella de Mariotte (Figura 1).
Figura 1: Simulación in vitro siguiendo un modelo abierto de 2 compartimentos: 1. Botella de mariotte.2.Matraz de vástago. 3. Matraz de fondo plano con vástago.
La Figura 2 muestra la representación del modelo abierto de dos compartimientos al cual se ajustaron los datos para obtener los parámetros farmacocinéticos de las nanoesferas de oro.
Figura 2: Representación esquemática del modelo abierto de dos compartimientos con eliminación de primer orden. X1 representa el compartimiento central, X2 es el compartimiento periférico, y k12 y k21 son las constantes de transferencia donde ke simula la constante de velocidad de eliminación.
La siguiente tabla muestra los parámetros farmacocinéticos promedio obtenidos en la simulación de las nanoesferas de oro (AuNPs) siguiendo un modelo abierto de dos compartimientos.
Tabla 1. Parámetros farmacocinéticos obtenidos tras la simulación de nanopartículas de oro in vitro.
La siguiente tabla muestra los parámetros farmacocinéticos promedio obtenidos en la simulación del conjugado AuNPs-LAN siguiendo un modelo no lineal de infusión.
Dado que no existen reportes relacionados con la información farmacocinética de las nanoesferas de oro (AuNPs), ni del conjugado (AuNPs-LAN) a la fecha, nosotros reportamos los resultados del estudio farmacocinético de éstos compuestos.
Con fundamento al comportamiento de éstas nanoestructuras podemos inferir qué los parámetros farmacocinéticos solo tienen importancia si son interpretados en base al proceso biológico que representan. En este caso estudiamos el funcionamiento de un delicado y complejo sistema que es “organismo-nanofármaco” y que la comprensión de este sistema se aborda a partir de la interpretación de un modelo abierto de dos compartimientos en el caso de las nanopartículas de oro y de un modelo de infusión para el conjugado AuNPs-LAN.
Lo cual demuestra que los datos obtenidos de la simulación realizada para las AuNPs se ajustaron al modelo abierto de dos compartimientos MADC, no así para el conjugado en estudio AuNPs-LAN, cuyos datos se ajustaron a un sistema de infusión, modelo independiente fundamentado por el ajuste no lineal de mínimos cuadrados realizado en el programa WinNonlin.
Hasta el momento no existe información reportada de los parámetros farmacocinéticos relacionada con el conjugado Au-LAN por lo cual en este proyecto reportamos los perfiles y parámetros farmacocinéticos obtenidos tras la simulación realizada in vitro (Figura 1). Sin embargo existe información relacionada con la farmacocinética del péptido lanreótido. Para el conjugado lanreótido el parámetro farmacocinético tiempo de vida media no se obtuvó aplicando el programa WinNonlin, por tal razón se calculó este parámetro conociendo la constante l= 0.328 ± 0.072 min-1, el cual fue t1/2= 2.3 ± 0.269 min. El volumen de distribución promedio, Vd= 1.625 ± 0.182 mL obtenido utilizando el programa no es muy confiable ya que la variación es muy grande respecto al valor promedio. Con estos datos se pudo calcular la depuración promedio CL=0.527 ± 0.083 mL/min.
En el caso de las nanopartículas de oro se obtuvo la siguiente farmacocinética: tiempo de vida media t1/2= 254 ± 81 min, el volumen de biodistribución Vd=69.49 ± 0.113 ml y finalmente la constante de eliminación ke=0.020 ± 0.0016 min-1.
Finalmente se realizó un análisis de variancias para comprobar si los parámetros farmacocinéticos obtenidos son diferentes de las AuNPs y del conjugado AuNPs-LAN, comprobando que para parámetros farmacocinéticos como Vd, ABC0∞, MRT y CL los valores obtenidos difieren respecto a los valores obtenidos del conjugado AuNPs-LAN así como para el valor de la constante de eliminación, ya que la varianza calculada de los valores de las AuNPS para el caso de la constante de velocidad de eliminación ke fue F=20>8.68 (F de tablas). La varianza obtenida de los parámetros farmacocinéticos mencionados (Vd, ABC0∞, MRT y CL) es diferente y menor al valor de tablas como se muestra en la tabla 2, por lo cual podemos decir que si existe diferencia significativa en el cálculo de dichos parámetros.
Es importante tener la información de los parámetros farmacocinéticos obtenidos tras las simulaciones realizadas en este trabajo de investigación, ya que esta información compromete a la continuidad en el desarrollo de nuevos sistemas nanoestructurados para fines biomédicos y permite dar alcance a nuevas alternativas en el control de la posología personalizada para tratamiento de enfermedades crónico-degenerativas y especialmente en el tratamiento de cáncer.
1. Roa, W., Zhang, X., Guo, L., Shaw, A., Hu, X., Xiong, Y., Gulavita, S., Patel, Xuejiun, S.S,, Chen, J., Moore, R. & Xing, J.Z. (2004). Gold nanoparticle sensitize radiotherapy of prostate cancer cells by regulation of the cell cycle. Nanotechnology, 20, 1-9.
2. Daniel, M.C. & Astruc D. (2004). Gold nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Prorpierties and Applications toward Biology, Catalysis and Nanotechnology. Chemical Reviews, 104, 293-346.
3. Molina-Trinidad, E.M., Arteaga de Murphy, C., Jung-Cook, H., Murphy-Stack, E., Pedraza-López, M., Morales-Marquez, L. & Vertiz-Serrano, G. (2010). Therapeutic 188Re-lanreotide: determination of radiopharmacokinetic parameters in rats. Journal of Pharmacy and Pharmacology, 62, 456-461.
4. Molina-Trinidad, E.M., Arredondo-Ochoa, L., Mendoza-Oaxaca, E., Huerta-Valencia, V., Escobar-Chávez J.J. & Hoyo-Vadillo, C. (2011). Development and Validation of a Method Spertrophotometric for Quantify GNPs and GNPs-Lanreotide In vitro. Journal of Pharmaceutical Science and Technology, 3(6), 608-612.
5. Molina-Trinidad, E.M., Estévez-Hernández, O., L., Rendón, L., Garibay-Febles, V. & Reguera, E. (2011). Electronic and vibrational spectra of novel Lanreotide peptide capped gold nanoparticles. Spectrochim Acta Mol Biomol Spectrosc, 82(1), 283-289.
6. Molina-Trinidad, E.M. et al. (2014). Somatostatin Analogs, How Biomarker in the Diagnostic and Treatment for Cancer and Others Damages. International Journal of Pharmaceutical Sciences Review and Reserch, 27(1), 31-46.
7. Molina-Trinidad, E.M., Estévez-Hernández, O., Cruz-Castañeda, A., Ariza-Ortega, J.A., Pliego-Pastrana, P. (2015). Validation and Characterization of nanoparticles AuNPs and AuNPs-LAN conjugate for capillary electrophoresis. International Journal of Pharmaceutical Sciences Review and Reserch, 6 (6), 2328-2338.
Correo de Correspondencia: mariaeva_molina@yahoo.com.mx
[a] Área Académica de Medicina, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo.