Obtención de gas metano
Resumen
En esta práctica los estudiantes realizan la obtención de un hidrocarburo alifático, el gas metano, un alcano simple; a través de la elaboración de acetato de sodio y cal sodada, en donde se analiza su ecuación a partir del acetato de sodio, así como la ecuación de su combustión, además de reforzar la manipulación adecuada del material de laboratorio y reactivos; con lo que el estudiante puede deducir algunos de los múltiples usos del gas metano.
Palabras clave: Hidrocarburos, Alcanos, Metano, acetato de sodio, cal sodada
Abstract
In this practice students obtain aliphatic hydrocarbons, methane gas, a simple alkhane, through the elaboration of sodium acetate and soda lime, where its equation is analyzed from sodium acetate, as well as the equation of its combustion, besides reinforcing the adequate handling of laboratory material and reagents; with which the student can deduce some of the multiple uses of methane gas.
Keywords: Hydrocarbons, Alkanes, Methane, sodium acetate, soda lime
Objetivo General
El estudiante será capaz de obtener gas metano, comprobar algunas de sus propiedades, para deducir la importancia que tiene, así como sus aplicaciones.
Introducción
El metano es un hidrocarburo alifático con fórmula CH4 también conocido como hidruro de metilo o gas de los pantanos, es utilizado principalmente como iniciador para la síntesis de gran variedad de sustancias orgánicas; dentro de las más importantes son cloroformo, tetracloruro de carbono, acetileno, alcoholes, aldehídos y ácidos orgánicos, así también para la producción de amoniaco y como gas combustible, usualmente para su presentación lo ubicamos como gas comprimido en cilindros.
Desarrollo Práctico
Material y reactivos
- 1 tripie
- 1 tela de asbesto
- 1 lámpara de alcohol
- 1 cápsula de porcelana
- 1 espátula
- 1 balanza
- 2 vidrio de reloj
- 1 varilla de vidrio
- 1 tubo de ensayo de 25 x200 mm
- 1 tapón
- 1 tubo de desprendimiento
- 1 encendedor o cerillos
- 1 mortero con pistilo
- 22.9 ml Ácido acético (C2H4O2)
- 2.6 Bicarbonato de sodio (NaHCO3)
- 2.5 mg de Hidróxido de sodio (NaOH )
- 2.5 mg de Oxido de calcio (CaO )
Proceso de elaboración
Obtención de acetato de sodio
El estudiante coloca 2.6g de NaHCO3 con 22.9ml de C2H4O2, se mezcla, se coloca en una cápsula de porcelana y se calienta hasta obtener el acetato de sodio.
Obtención de cal sodada
El estudiante tritura en un mortero 2.5g de NaOH y añade poco a poco 2.5 g de CaO hasta obtener una mezcla homogénea, de forma rápida debido a que el NaOH se deshidrata rápidamente al contacto con el aire.
Obtención del gas metano
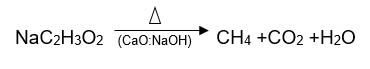
En una cápsula de porcelana coloca 2.5g de acetato de sodio y calienta hasta que la sal se funda con el fin de eliminar la humedad, se deja enfriar y se repite la operación calentando suavemente para evitar la descomposición del acetato, hasta obtener un polvo gris.
Una vez frio, agrega 2.5g de cal sodada, mezcla perfectamente y vacía en un tubo de ensayo de 25 x 200 mm completamente seco y provisto de tapón con tubo de desprendimiento y procede a calentar.
Acerca un cerillo encendido al extremo del tubo de desprendimiento y comprueba la combustibilidad del metano.
Resultados obtenidos
Acetato de sodio
La reacción del acetato de sodio
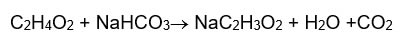
Cal sodada
Se realiza la mezcla 1:1 Hidróxido de sodio y CaO para su obtención. (CaO + NaOH)
Metano
Se logra apreciar la obtención del gas metano a partir de 3 minutos, mediante la aparición del gas, al acercar el cerillo se puede comprobar la combustibilidad al apreciarse una llama azulada, obteniendo la siguiente reacción:
Conclusión
El estudiante logra exitosamente la obtención del gas metano, un alcano simple, por medio de la descomposición acetato de sodio, con hidróxido de sodio y óxido de calcio, mediante la aplicación de calor, liberando el gas metano a través del tubo de desprendimiento, lo que le permite identificar una de sus propiedades.
Al realizar las mezclas se puede obtener el gas metano, logrando apreciar su combustibilidad al quemarse; la llama del metano es de color azul, debido a que la combustión con exceso de oxigeno es en general completa. El metano se oxida a CO2 y H2O pero si la combustión es incompleta se forma CO, H2O y un residuo carbonoso, llamado negro de humo.
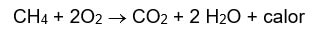
El gas metano es un compuesto muy útil en la humanidad, es un gas de efecto invernadero, lo que indica que su presencia en la atmosfera afecta la temperatura y el sistema climático de la tierra, tiene utilidad en la industria química en la elaboración de productos sintéticos, utilizado como combustible este es importante para la generación eléctrica, utilizado en las turbinas de gas o generadores de vapor, así como utilizado para uso común como calefacción o cocinas denominado como gas natural.
Referencias Bibliografías
Flores de L.T. y Ramírez de D.A. (2013). Química orgánica para nivel medio superior, Edición 19, Editorial Esfinge. México.
McMurry J.(2008). Química orgánica. Séptima edición. Editorial Cengage Learning. México.
Recio, F. (2009). Química orgánica bachillerato. Editorial Mc Graw Hill. México.
Manual de prácticas de Laboratorio Quimica orgánica (2016). Textos Escolares Uniersitarios U.A.E.H.
Magaña R., J., & Torres R., E., & Martínez G., M., & Sandoval Juárez, C., & Hernández Cantero, R. (2006). Producción de Biogás a Nivel Laboratorio Utilizando Estiércol de Cabras. Acta Universitaria, 16 (2), 27-37.
[a] Docente de la Universidad Autónoma del Estado de Hidalgo- Escuela Superior de Huejutla helea_lozano9509@uaeh.edu.mx