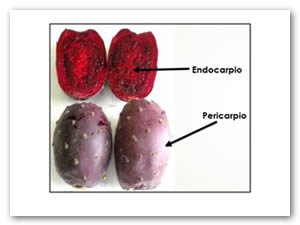
Figura 1. Morfología de la Tuna púrpura variedad 'orejón' (Opuntia megacantha).
En este trabajo se evaluó el efecto del secado por aspersión sobre la bioactividad y el color de extractos (pulpa, cáscara y/o sus mezclas) de frutos de Opuntia spp. y sus mezclas. Las microcápsulas fueron obtenidas con una temperatura de entrada de 175 °C, usando goma de mezquite como material de pared. Se determinó que el secado por aspersión tuvo un efecto estadísticamente significativo (P≤0.05) sobre el contenido de Betalaínas totales, siendo las formulaciones ET,0:1 y EX,3:7 las que presentaron un contenido significativamente mayor (p ≤ 0.05). Los contenidos de fenoles totales, flavonoides, actividad antioxidante por ABTS y DPPH, así como el color, en las formulaciones ET,3:7 y EX,3:7 fueron influenciados por la presencia del material de pared en las microcápsulas. Los extractos de xoconostle fueron menos susceptibles a degradación mediante secado por aspersión comparados con los extractos de tuna. Mientas que las betalaínas pueden ser un buen indicador la degradación de los extractos microencapsulados con goma de mezquite.
Palabras clave: Tuna, Xoconostle, Pigmentos, Secado por aspersión, Microcápsulas, Goma de mezquite.
The effect of spray drying on the bioactivity and color extracts (pulp, peel and/or mixtures) of Opuntia ssp was evaluated in this work. The microcapsules were obtained with an inlet temperatura of 175°C using mesquite gum as wall material. It was determined that spray drying had a statistically significant effect (P≤0.5) on the contents of total Betalains, the E T,0:1 and E X,3:7 formulations had a significantly higher content (P≤0.5). The contents of total phenols, flavonoids, antioxidant activity by ABTS and DPPH as well as color in the E T,3:7 and E X,3:7 formulations were influenced by the presence of wall material in the microcapsules. Xoconostle extracts were less prone to degradation by spray drying compare to tuna extracts. Betalains can be a good degradation indicator of the microencapsulated extracts with mesquite gum.
Keywords: Tuna , Xoconostle , Pigments , Spray drying , Microcapsules , Mesquite gum.
La tuna es un fruto que morfológicamente está constituido por una cáscara gruesa y espinosa (pericarpio) y abundantes semillas distribuidas heterogéneamente en la pulpa (endocarpio) como se muestra en la Figura 1. Es considerado como un alimento con un gran valor nutritivo, ya que aporta vitaminas, proteínas y minerales; es muy jugosa, saludable y presenta excelentes propiedades para la digestión ya que contiene fibra en sus semillas, presenta un sabor exquisito con un índice glucémico bajo y contenido nutrimental excepcional debido a la cantidad de calcio, fósforo, potasio y magnesio (Tomás, et al., 2012).
Este fruto se consume en fresco, contiene altos niveles de agentes antioxidantes tales como ácido ascórbico, compuestos fenólicos y pigmentos, así como altas concentraciones de calcio, magnesio, prolina y taurina, que le confieren características de un alimento funcional (Ochoa y Guerrero, 2010).
La tuna presenta una amplia gama de colores, la coloración del fruto está determinada por la presencia de pigmentos entre los cuales se encuentran las betalaínas y los carotenoides. Los pigmentos pueden estar presentes en la cáscara y en la pulpa de las distintas variedades. Los colores del fruto incluyen el blanco, amarillo, naranja, rojo y púrpura (Figueroa, et al., 2010; Aquino, et al., 2012). Entre las propiedades que tiene este fruto son: un alto contenido de vitamina C (ácido ascórbico), calcio, hierro y pectinas en comparación con otros frutos como el plátano, el durazno y la pera, así como un considerable aporte de fibra y pigmentos hidrosolubles característicos como las betalaínas y los compuestos fenólicos los cuales son responsables del color del fruto y la actividad antioxidante (Torres, et al., 2014). La combinación de fenoles solubles, vitamina C y las betalaínas que contiene éste fruto, lo ubica como un fruto rico en antioxidantes que supera a la fresa, mora azul y la cereza (SAGARPA, 2011).
Los Xoconostles se distinguen por presentar paredes interiores anchas, ácidas, pared exterior delgada, semillas dispuestas en el centro del fruto, con funículos semisecos e insípidos, con la característica particular de que sus frutos permanecen sobre los cladodios durante todo el año o más probablemente por sus bajas tasas de producción de etileno al madurar (Gallegos, et al., 2014). En cuanto a su morfología (Figura 2) los xoconostles presentan una cáscara o piel (epicarpio) con un color entre rosa-rojo ligero y una suculenta pulpa (mesocarpio) con una coloración entre amarillo-rosa, en el centro se localizan las semillas (endocarpio) de color café, estas se encuentran embebidas formando así un compuesto mucilaginoso de color rojo (Osorio, et al., 2011; Morales, et al., 2014). La cáscara de los xoconostles aporta un tercio del requerimiento mínimo diario de vitamina C para un adulto, es decir, 60 miligramos. La piel de xoconostle contiene siete veces más antioxidantes que la pulpa (SAGARPA, 2011).
Los frutos de Opuntia, además de los nutrientes esenciales y de una serie de micronutrientes tales como minerales, fibras y vitaminas, aportan diversos componentes como metabolitos secundarios de naturaleza fenólica, denominados polifenoles. El consumo de frutas y verduras está asociado al bajo riesgo de incidencias y mortalidad de cáncer así como enfermedad coronaria. Los fenoles, especialmente los flavonoides y las antocianinas, muestran una gran capacidad para captar radicales libres causantes del estrés oxidativo, atribuyéndoseles a su vez un efecto benéfico en la prevención de enfermedades; cardiovasculares, circulatorias, cancerígenas y neurológicas. Poseen actividades anti-inflamatoria, antialérgica, antitrombótica, antimicrobiana y antineoplásica (Kukoski, et al., 2005). Por tanto, un aumento en la ingesta de estos antioxidantes en la dieta puede proteger de enfermedades crónicas. Además, la industria de alimentos incorpora antioxidantes naturales de tejidos vegetales debido a las restricciones legales para usar colorantes sintéticos (Figueroa, et al., 2010).
El color es uno de los atributos de los alimentos, considerado como un indicador de la calidad y determina con frecuencia su aceptación en el mercado (Azeredo, 2009).
Actualmente son relativamente pocos los alimentos industrializados que no contienen colorantes. Debido a que el color es considerado como un atributo que aumenta el atractivo de los alimentos y está vinculado con su calidad. A raíz de la creciente preocupación por los posibles efectos tóxicos de los colorantes sintéticos, se proponen como posibles reemplazantes a los pigmentos de origen natural, que son percibidos por los consumidores como inocuos y saludables (González, et al., 2014). La FDA es un organismo encargado de la Administración de Drogas y Alimentos en Estados Unidos, define como aditivo colorante a cualquier pigmento o sustancia fabricada u obtenida de vegetales, animales o minerales capaces de colorear alimentos, drogas, cosméticos o alguna parte del cuerpo humano. Existen colorantes artificiales que son producidos a partir de una síntesis química y los colorantes naturales denominados “pigmentos” que son extraídos de fuentes naturales.
Los colorantes artificiales son ampliamente utilizados debido a que su poder colorante es más intenso que el de los naturales, así, se requieren cantidades menores para lograr el mismo efecto de color. Además, estos colorantes son más estables, proveen mejor uniformidad de color y se mezclan más fácilmente, resultando en una amplia gama de tonalidades. Los colorantes artificiales, generalmente no imparten sabores extraños a los alimentos que se agregan, mientras que los que se derivan de otros alimentos, pueden producir este efecto indeseado (Parra, 2004; Sánchez, 2013). Sin embargo, el consumo de este tipo de sustancias se ha visto relacionado con toxicidad en órganos humanos.
Los pigmentos de origen natural, se clasifican en clorofilas, carotenoides, fenoles y betalaínas, estos últimos son alcaloides derivados de la tirosina que pueden ser de dos tipos: las betacianinas que son de color rojo-violeta y las betaxantinas con tonalidades amarillas-naranjas, ambas con el cromóforo común del ácido betalámico (González, et al., 2014). El uso de estos pigmentos requiere del conocimiento químico de sus moléculas y de su estabilidad, con el fin de optimizar su funcionalidad en las condiciones de procesamiento, empacado y distribución. La industria requiere de tecnologías que protejan a los pigmentos naturales del ambiente, debido a su inestabilidad con la presencia de luz, aire, humedad y altas temperaturas. Actualmente, una alternativa es la tecnología de la microencapsulación (Parra, 2010).
Los alimentos están compuestos por un gran número de sustancias que se clasifican principalmente en tres tipos: nutrientes, compuestos indeseables o antinutricionales y compuestos bioactivos (Urango, et al., 2008.
Los compuestos bioactivos se definen como aquellos compuestos químicos que ejercen un efecto benéfico para alguna función corporal del individuo, produciendo una mejora en su salud y bienestar o reduciendo un riesgo de enfermedad. Son compuestos que exhiben propiedades farmacológicas; para el caso específico de los vegetales comestibles se les denomina fitoquímicos. Recientes trabajos de investigación científica han permitido clasificar a los compuestos bioactivos presentes en los alimentos de origen vegetal, en grupos según las funciones de protección biológica que ejercen y sus características físicas y químicas (Sainz, 2006).
Los alimentos funcionales han tomado gran importancia en la alimentación actual, pues además de nutrir, aportan algunos compuestos bioactivos. Para que un alimento sea declarado como funcional, por sus propiedades nutricionales y saludables en función de sus nutrientes, debe comprobarse con una evidencia científica válida y suficiente para justificar las declaraciones (Urango, et al., 2008). Algunos de los compuestos bioactivos que se les da una mayor importancia son los polifenoles y antocianas, los cuales tienen efectos benéficos para la salud debido a su elevada capacidad antioxidante (Gorena, et al., 2010).
Por lo tanto se ha observado un creciente interés en el estudio de frutas y hortalizas que aporten compuestos bioactivos antioxidantes, con el fin de potenciar su consumo debido a su efecto positivo en la prevención de ciertas enfermedades crónicas (Gorena, et al., 2010).
La microencapsulación es definida como una tecnología de empaquetamiento de materiales sólidos, líquidos o gaseosos. Contribuye al incremento de la vida útil y a una liberación controlada del encapsulado. Consiste en la obtención de micropartículas conformadas por una membrana polimérica porosa que contiene a la sustancia activa. El material o las mezclas de los materiales que se van a microencapsular pueden ser cubiertos o atrapados dentro de otro material o sistema. Una microcápsula consiste de una membrana semi-permeable, esférica, delgada y fuerte alrededor de un centro solido/líquido, con un intervalo que va desde sub-micra hasta varios milímetros de tamaño. Con un material encapsulante adecuado se puede brindar estabilidad a los principios activos inestables (Parra, 2010; Fang, 2010 y Desai y Park 2005).
El microencapsulado mediante secado por aspersión corresponde a la transformación de un fluido en un material sólido, atomizándolo en forma de gotas minúsculas en un medio de secado en caliente. La distribución del tamaño de las partículas obtenidas por este método es en general de 10 a 100 µm, aunque ello depende de las condiciones del proceso. Una de las grandes ventajas de este proceso, además de su simplicidad, es que es apropiado para materiales sensibles al calor, ya que el tiempo de exposición a temperaturas elevadas es muy corto variando entre 5 y 30 segundos (Pedroza, 2002., Parra, 2010; Fang, 2010).
Los materiales encapsulantes más utilizados para el método de secado por aspersión han sido: Carbohidratos (almidón y derivados, maltodextrinas, jarabes de maíz, ciclodextrinas, carboximetilcelulosa y derivados); gomas (arábiga, mezquite, alginato de sodio); lípidos (ceras, parafinas, grasas) y proteínas (gelatina, proteína de soya, caseinatos, suero de leche, zeína) (Pedroza, 2002).
Por todo lo anterior es que surge el objetivo de esta investigación que fue obtener microcápsulas mediante secado por aspersión que protejan a los pigmentos obtenidos de la cáscara y/o de la pulpa de tuna púrpura variedad 'Orejón' y xoconostle variedad 'Ulapa' contra su degradación usando goma de mezquite como material de pared. Ya que el principal objetivo de la microencapsulación es proteger el material del núcleo de las condiciones ambientales desfavorables, tales como la luz, humedad y oxígeno.
Aquino, B. E.; Chavarría, M.Y.; Chávez, S.J.; Guzmán, G.R.; Silva, H.E. & Verdalet, G.I. (2012). Caracterización fisicoquímica de siete variedades de tuna (Opuntia spp.) color rojo-violeta y estabilidad del pigmento de las dos variedades con mayor concentración. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes. 55, 3-10.
Azeredo, H. (2009). Betalains properties, sources, applications, and stability – a review. Food Science & Technology. 44, 2365–2376.
Fang, Z. y Bhandari, B. (2010). Encapsulation of polyphenols - a review. Trends in Food Science & Technology 21, 510-523.
Figueroa, C.I., Martínez, D.M., Rodríguez, P.E., Colinas, L.A., Valle, G.S., Sweetia, R.R. y Gallegos, V.C. (2010) Pigments content, other compounds and antioxidant capacity in 12 cactus pear cultivars (Opuntia spp.) from Mexico. Agrociencia 44:763-771
González, A.E., Campos, M.R., Pinedo, E.J., Aguirre, A.G. y Hernández, F.A. (2014). Stability of color in extracts from different genotypes from red prickly pear (Opuntia spp.). Revista Científica Biológico Agropecuaria Tuxpan 2(4): 728-735.
González, A.E. (2014). Aplicación de pulsos eléctricos de alto voltaje en la extracción de pigmentos y compuestos antioxidantes de tunas rojas (Opuntia spp.). Tesis para obtener el grado de Maestra en Ciencia de los Alimentos. Universidad Autónoma del Estado de Hidalgo.
Gorena, T., Sepúlveda, E., Sáenz, C. (2010). Compuestos Bioactivos y actividad antioxidante de frutos de granado (Punica granatum I.). Ingredientes funcionales. La alimentación Latinoamericana. N° 285. 48-52.
Kukoski, E., Asuero, A., Troncoso, A., Mancini-Filho, J., y Fett, R., (2005). Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos. Ciência e Tecnologia de Alimentos, 25: 726-732.
Morales, P.; Barros L.; Ramírez, M.E.; Santos, B.C. y Ferreira, I. (2014). Exploring xoconostle by-products as sources of bioactive compounds. Food Research International 65. 437–444.
Ochoa, C. E. & Guerrero J. A. (2010). La tuna: una perspeciva de su producción, propiedades y métodos de conservación. Temas Selectos de Ingeniería de Alimentos, 4 (1): 49-63.
Osorio, E. O., Ortiz, M. A., Álvarez V.B., Dorantes, A. L. y Giusti M. M. (2011). Phenolics, betacyanins and antioxidant activity in Opuntia joconstle fruits. Food Research International. 44: 2160-2168.
Parra, H.R. (2010). Food Microencapsulation: A Review. Revista Facultad Nacional de Agronomía Medellín 63(2):5669-5684.
Parra, O.V. (2004). Estudio comparativo en el uso de colorantes naturales y sintéticos en alimentos desde el punto de vista funcional y toxicológico. Tesis como requisito para el grado de Licenciado en Ciencias de los Alimentos. Chile.
Pedroza, I.R. 2002. Alimentos Microencapsulados: Particularidades de los Procesos para la Microencapsulación de Alimentos para Larvas de Especies Acuícolas. Memorias del VI Simposium Internacional de Nutrición Acuícola. México.
SAGARPA (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación). (2011). Consultado online http://www.sagarpa.gob.mx/saladeprensa/boletines2/2011/julio/Documents/2011B371.pdf.
Sánchez, J.R. (2013) La química del color en los alimentos. Química viva. Número 3, 234-246.
Tomás, Ch.G., Huamán, M.J., Aguirre, M.R., Bravo, A.M., León, Q.J., Guerrero, A.M., Orihuela, R.C., Avelés, O.R. y Yanqui, D.E. (2012). Estudio químico y fitoquímico de la Opuntia ficus-indica “tuna”, y elaboración de un alimento funcional. Rev. Per. Quím. Ing. Quím. Vol. 15: 70-74.
Torres, M.E.; Ramírez, C.C.; Llamas, P.M.; Blancas, N.J.; Jiménez, G.E. & Sánchez, P.M. (2014). Caracterización química y funcional del xoconostle (Opuntia xoconostle variedad weber). XIX Congreso Nacional de Ingeniería Bioquímica VIII Congreso
Urango, M. L., Montoya, P. G., Cuadros, Q.M., Henao, C. D., Zapata, A. P., López, M. L., Castaño, E., Serna, L. A., Venegas, C., Loaiza, M., Davahiva, G. B. (2008). Efecto de los compuestos bioactivos de algunos alimentos en la salud. Perspectivas en salud humana. Vol. 11. 29-38.
[a] Instituto de Ciencias Agropecuarias, Universidad Autónoma del estado de Hidalgo, Av. Rancho Universitario s/n Km. 1. Tulancingo, Hidalgo, 43600, México.
[b] Instituto de Ciencias Agropecuarias, Universidad Autónoma del estado de Hidalgo, Av. Rancho Universitario s/n Km. 1. Tulancingo, Hidalgo, 43600, México.
[c] Instituto de Ciencias Agropecuarias, Universidad Autónoma del estado de Hidalgo, Av. Rancho Universitario s/n Km. 1. Tulancingo, Hidalgo, 43600, México.
[d] Instituto de Ciencias Agropecuarias, Universidad Autónoma del estado de Hidalgo, Av. Rancho Universitario s/n Km. 1. Tulancingo, Hidalgo, 43600, México.