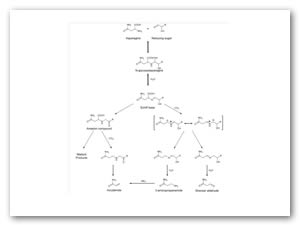
Figura 1: propuesto para la formación de acrilamida como reacción secundaria de la reacción de Maillard. (Medeiros Vinci, 2012).
La acrilamida es una sustancia con actividad química significativamente alta, con diferentes usos industriales. Se forma en los alimentos debido a la presencia de hidratos de carbono (glucosa) y aminoácidos (principalmente asparagina) sometidos a temperaturas (productos fritos, pan y café). Esta condición además de disminuir el valor biológico y nutricional de los alimentos, también incide en la seguridad alimentaria de éstos. La glicidamida, el metabolito activo de la acrilamida posee propiedades cancerígenas, neurotóxicas y genotóxicas. Debido a esto, existe la necesidad de desarrollar técnicas que reduzcan la presencia y/o el desarrollo de acrilamida en los alimentos. Entre las estrategias que se utilizan en la industria de los alimentos, para su disminución está la adición de la enzima asparaginasa y compuestos antioxidantes durante el proceso de producción de alimentos.
Palabras clave: Acrilamida, Hidratos de Carbono, Antioxidantes, Asparagina
The acrylamide is a substance with a higher chemical activity and has been used in different ways in the industry. This compound is formed in the food when the carbohydrates and the amino acids are exposed to high temperatures (fried products, bread and coffer). The presence of this compound not only decreases the biological and nutritional value of the foods, but also affects their food safety. The glycidamide, active metabolite of the acrylamide, has carcinogenic, neurotoxic and genotoxic properties. For this reason is necessary to develop techniques that can decrease the presence and the development of acrylamide in foods. One of the principal strategies that has been used in the Food Industry is the addition of asparaginea, an enzyme, and ntioxidant compounds.
Keywords: Acrylamide, carbohydrates, antioxidants, asparagine
La acrilamida es un monómero, clasificado como sustancia química intermedia empleada en diversas aplicaciones como son, la producción de poliacrilamidas para mejorar la adherencia y entrecruzar los polímeros, además para la síntesis de colorantes, copolímeros en lentes de contacto, en túneles como aditivo para el tratamiento de aguas residuales, como aditivo en cosméticos y geles de electroforesis, en la fabricación de papel y espesantes (Medeiros Vinci, 2012; Codex, 2004). Dicho monómero se presenta en forma cristalina blanca, es soluble en agua, etanol, metanol, éter dimetílico y acetona.
La formación de acrilamida, emplea como constante de factor de riesgo la temperatura, esta aumenta de forma rápida en la superficie de los alimentos en condiciones convencionales, haciéndola más susceptible a reacciones químicas que conducen la formación de compuestos tóxicos no deseados, por lo que se ha informado que el desarrollo de acrilamida tiene lugar principalmente en la superficie de los alimentos (Gökmen, 2016). En la Fig. 2 se muestra el mecanismo de formación de la acrilamida, implica la reacción de un compuesto carbonilo, con asparagina, resultando en la correspondiente conjugación N-glicosilo y la formación de una base de Schiff descarboxilada (después del proceso a altas temperaturas) (Medeiros Vinci, 2012; Riboldi, 2014).
Esta reacción implica una cascada de reacciones con diferentes productos intermedios, que resultan en la formación de acrilamida por diferentes vías; a) en primera instancia, ocurre la descarboxilación de la base de Schiff que puede conducir después a acrilamida, seguida de hidrolisis para 3-aminopropamida (3-APA), esto ocurre en papas como tal; b) la eliminación subsecuente del amoniaco a partir de 3-APA que conduce directamente a acrilamida; c) la hidrolisis de la amina que proporciona el aldehído de Strecker de la asparagina (3-oxopropanamida) también puede producir acrilamida. Otras rutas se han propuesto para la formación de acrilamida, como por ejemplo a partir de amoniaco y acroleína en ausencia de asparagina, una vía sugerida en alimentos ricos en lípidos (Medeiros Vinci, 2012). En relación a esto Xu y col. (2014), demuestran que la formación de acrilamida a través de la reacción de Maillard, no es la única vía de formación, sino que también es posible su formación a partir de lípidos a temperaturas elevadas y las vías de metabolismo de proteínas, también pueden dar resultado a la formación de este compuesto.
Elmore y col. (2005), reportaron que la acrilamida puede formarse en los alimentos por tres mecanismos: 1) Directamente a partir de los aminoácidos, 2) A través del ácido acrílico que puede provenir de la degradación de los lípidos, hidratos de carbono o aminoácidos libres, y 3) Mediante la deshidratación y/o descarboxilación de ciertos ácidos orgánicos comunes incluyendo el ácido málico, láctico y cítrico.

Figura 1: propuesto para la formación de acrilamida como reacción secundaria de la reacción de Maillard. (Medeiros Vinci, 2012).
La acrilamida fue clasificada en el grupo A2 por la Agencia Internacional para la investigación del Cáncer (IARC, 1994), y carcinogénico categoría 2, mutágeno categoría 2, por la Unión Europea (FAO/OMS, 2002), debido a los resultados obtenidos en experimentación con animales. La acrilamida es un compuesto reactivo con materiales biológicos, que al ser ingerido, se absorbe directamente en la circulación sanguínea; en investigaciones con modelos animales, se ha demostrado, que atraviesa la barrera hematotesticular y es posible que también atraviese la barrera placentaria, llegando al feto (Dearfield, 1995; Parzefall, 2008), Su metabolito activo conocido como glicidamida, es más reactivo que la acrilamida (Riboldi, 2014). Las exposiciones a acrilamida y sus efectos tóxicos, han sido documentados por la Agencia Internacional de Investigación para el Cáncer (IARC), desde 1994, y la OMS y su comité de Expertos en Aditivos Alimentarios (JECFA) en 2005, además de evaluar sus riesgos nutricionales y la idea de modificar con base a esta premisa los procesos en la producción de alimentos, es un referente en la industria alimentaria. En 1985, la OMS estableció para la acrilamida un valor de ingesta diaria tolerable (IDT), de 12 μg/kg de peso corporal/día, basado en la neurotoxicidad establecida en modelos animales con roedores, a dosis repetidas. Sin embargo, la evaluación presentada a dichos riesgos presentados, es muy conservadora, por lo que los verdaderos niveles de riesgo, pueden ser menores (Dybing, 2005). Estudios epidemiológicos reportados por Rice y col. (2005), indican un posible riesgo para desarrollar algún tipo de cáncer, basados en algunos casos de toxicidad accidental en humanos y pruebas en animales, buscando establecer la relación entre la exposición de acrilamida en la dieta como factor de riesgo para esta enfermedad (Cebi, 2016). La neurotoxicidad de acrilamida se conoce de intoxicaciones accidentales y de las exposiciones a ocupaciones crónicas, encontrándose principalmente neuropatías periféricas, degradación de axones en el sistema nervioso central, deterioro en las funciones cognitivas y daño cerebral (Garey, 2007); estos efectos son reproducibles en animales con estudios dosis-respuesta (Parzefall, 2008). Además, con relación a la genotoxicidad, la glicidamida puede generar daños específicos en el ADN, como aberraciones cromosómicas (Dearfield, 1995). Zeynep Atay y col. (2005) reporta, que la exposición a acrilamida se ha relacionado con distintos tipos de cáncer, entre los que destacan, neoplasias en cerebro, cabeza, cuello, tiroides, en cavidad oral, faringe, laringe, esófago, gastrointestinal, y colorrectal, páncreas, pulmón, mama, endometrio y ovario, próstata aparato urogenital y riñón. Entre los tratamientos alternativos y preventivos para el desarrollo de estos padecimientos está el consumo de compuestos antioxidantes, que poseen la capacidad de reducir el estrés oxidativo y la eliminación de radicales libres, lo que les confiere actividad biológica como anticancerígenos por diferentes mecanismos aún no descritos (Knect, 2002).
La acrilamida puede formarse en tratamientos térmicos en el desarrollo de alimentos, especialmente en aquellos ricos en carbohidratos y aminoácidos (Lineback, 2012). A partir de su identificación en los alimentos se han desarrollado e implementado estrategias para su inhibición de su formación, entre las que destacan: la disminución de temperatura y tiempo, la elección de agentes o aditivos como polifenoles que intervienen en la reducción de la formación de acrilamida, el contenido de azucares reductores y aminoácidos libres como la asparagina (Liu, 2015; Morales, 2014), compuestos de origen natural, como plantas y extractos de estas, que intervengan en el mecanismo de formación de este monómero de forma parcial o total (Jin, 2013). La concentración de acrilamida varía enormemente de un alimento a otro, dependiendo de los factores de su procesamiento. Al ser la temperatura causa importante sobre el desarrollo de acrilamida, dentro de las alternativas para la disminución en la formación de este compuesto, está el monitoreo de temperatura constante, para superar los 175°C. En alimentos en los que en su proceso de elaboración se superaron los 200°C, la acrilamida fue fácilmente detectable, mientras que temperaturas por debajo de 120°C, no se detecta acrilamida, por lo que concluyen como buena alternativa, la disminución del tiempo de cocción y temperatura, como estrategia para la inhibición en la formación de este compuesto (FAO/OMS, 2002; Amrenin, 2004). Los antioxidantes, pueden inhibir la formación de acrilamida, previniendo la oxidación de lípidos, y limitando la acumulación de carbonilos, funcionando además como intermediarios en la reacción de Maillard. Los flavonoides presentes en fuentes naturales poseen actividad farmacológica y funcional, dando a los productos que las contienen atributos antioxidantes (Cheng, 2015). Chirinos y col. (2009), reportan que la adición de antioxidantes en alimentos que durante su proceso se someten a altas temperaturas provoca una disminución en la cantidad de acrilamida formada, mientras que Ou y col. (2010), encontraron que a la adición de antioxidantes en procesos de fabricación de alimentos a altas temperaturas podría inhibir la formación de acrilamida, proponiendo los siguientes mecanismos: a) la acrilamida es destruida por sus productos oxidados, b) formación de quinonas o compuestos carbonilos, que reaccionan posteriormente con la asparagina, y c) inhibición de compuestos carbonilo a partir de aceite freído.
El empleo de compuestos antioxidantes, puede ser prometedor en la industria alimentaria, para la inhibición de la formación de compuestos no deseables como la acrilamida, que además, mejoren el valor nutricional de los alimentos.
Amrein, T., Schönbächler, B., Escher, F. and Amadò, R. (2004). Acrylamide in Gingerbread: Critical Factors for Formation and Possible Ways for Reduction. J. Agric. Food Chem., 52(13), pp.4282-4288.
CEBI A. (2016). Acrylamide Intake, Its Effects on Tissues and Cancer. In: V. Gökmen, Acrylamide in food, 1st ed. . ISBN: 9780128028759. Amsterdam: Elsevier. Academic Press.
Cheng, J., Chen, X., Zhao, S. and Zhang, Y. (2015). Antioxidant-capacity-based models for the prediction of acrylamide reduction by flavonoids. Food Chemistry, 168, pp.90-99.
Chirinos, R., Betalleluz-Pallardel, I., Huamán, A., Arbizu, C., Pedreschi, R. and Campos, D. (2009). HPLC-DAD characterisation of phenolic compounds from Andean oca (Oxalis tuberosa Mol.) tubers and their contribution to the antioxidant capacity. Food Chemistry, 113(4), pp.1243-1251.
Codex. Programa conjunto FAO/OMS sobre las normas alimentarias. Documento de debate sobre la acrilamida. Rotterdam, Paises bajos, pp. 22-26 de marzo de 2004.
Dearfield, K., Douglas, G., Ehling, U., Moore, M., Sega, G. and Brusick, D. (1995). Acrylamide: a review of its genotoxicity and an assessment of heritable genetic risk. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 330(1-2), pp.71-99.
Dybing, E., Farmer, P., Andersen, M., Fennell, T., Lalljie, S., Müller, D., Olin, S., Petersen, B., Schlatter, J., Scholz, G., Scimeca, J., Slimani, N., Törnqvist, M., Tuijtelaars, S. and Verger, P. (2005). Human exposure and internal dose assessments of acrylamide in food. Food and Chemical Toxicology, 43(3), pp.365-410.
Elmore, J., Koutsidis, G., Dodson, A., Mottram, D. and Wedzicha, B. (2005). Measurement of Acrylamide and Its Precursors in Potato, Wheat, and Rye Model Systems. J. Agric. Food Chem., 53(4), pp.1286-1293.
Garey, J. and Paule, M. (2007). Effects of chronic low-dose acrylamide exposure on progressive ratio performance in adolescent rats. NeuroToxicology, 28(5), pp.998-1002.
Gökmen V (2016). Analysis of Acrylamide in Foods with Special Emphasis on Sample Preparation and Gas Chromatography–Mass Spectrometry Detection. In: V. Gökmen, Acrylamide in food, 1st ed. . ISBN: 9780128028759. Amsterdam: Elsevier. Academic Press.
Jin, C., Wu, X. and Zhang, Y. (2013). Relationship between antioxidants and acrylamide formation: A review. Food Research International, 51(2), pp.611-620.
Knekt P, Kumpulainen J, Järvinen R, Rissanen H, Heliövaara M, Reunanen A, Hakulinen T, Aromaa A. (2002) Flavonoid intake and risk of chronic diseases. American Journal of Clinical Nutrition, 76:560–8
Lineback, D., Coughlin, J. and Stadler, R. (2012). Acrylamide in Foods: A Review of the Science and Future Considerations. Annual Review of Food Science and Technology, 3(1), pp.15-35.
Liu, Y., Wang, P., Chen, F., Yuan, Y., Zhu, Y., Yan, H. and Hu, X. (2015). Role of plant polyphenols in acrylamide formation and elimination. Food Chemistry, 186, pp.46-53.
Medeiros Vinci, R., Mestdagh, F. and De Meulenaer, B. (2012). Acrylamide formation in fried potato products – Present and future, a critical review on mitigation strategies. Food Chemistry, 133(4), pp.1138-1154.
Morales, G., Jimenez, M., Garcia, O., Mendoza, M. and Beristain, C. (2014). Effect of natural extracts on the formation of acrylamide in fried potatoes. LWT - Food Science and Technology, 58(2), pp.587-593.
OMS (Organización Mundial de la Salud) (2002). Health Implications of acrylamide in food. Report of a joint FAO/WHO Consultation, 25-27 June (Geneva:WHO).
Ou, S., Shi, J., Huang, C., Zhang, G., Teng, J., Jiang, Y. and Yang, B. (2010). Effect of antioxidants on elimination and formation of acrylamide in model reaction systems. Journal of Hazardous Materials, 182(1-3), pp.863-868.
Parzefall, W. (2008). Minireview on the toxicity of dietary acrylamide. Food and Chemical Toxicology, 46(4), pp.1360-1364.
Riboldi, B., Vinhas, Á. and Moreira, J. (2014). Risks of dietary acrylamide exposure: A systematic review. Food Chemistry, 157, pp.310-322.
Rice, J. (2005). The carcinogenicity of acrylamide. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 580(1-2), pp.3-20.
Stadler, R., Blank, I., Varga, N., Robert, F., Hau, J., Guy, P., Robert, M. and Riediker, S. (2002). Food chemistry: Acrylamide from Maillard reaction products. Nature, 419(6906), pp.449-450.
Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S. and Törnqvist, M. (2002). Analysis of Acrylamide, a Carcinogen Formed in Heated Foodstuffs. J. Agric. Food Chem., 50(17), pp.4998-5006.
Xu, Y., Cui, B., Ran, R., Liu, Y., Chen, H., Kai, G. and Shi, J. (2014). Risk assessment, formation, and mitigation of dietary acrylamide: Current status and future prospects. Food and Chemical Toxicology, 69, pp.1-12.
Zeynep Atay, N., Çalgan, D., Özakat, E. and Varnali, T. (2005). Acrylamide and glycidamide adducts of Guanine. Journal of Molecular Structure: THEOCHEM, 728(1-3), pp.249-251.
[a] Estudiante de posgrado en la Universidad Autónoma del Estado de Hidalgo, México. geraldynepaulin@hotmail.com
[b] Profesor Investigador de la Universidad Autónoma del Estado de Hidalgo, México. njgv2002@yahoo.com.mx
[c] Profesor Investigador de la Universidad Autónoma del Estado de Hidalgo, México. chipiloni@hotmail.com
[d] Profesor Investigador de la Universidad Autónoma del Estado de Hidalgo, México. auroraql@yahoo.com.mx