Efecto del tipo de enzima utilizado en el proceso de extraccion de colageno ovino hidrolizado
Resumen
En el presente trabajo se realizó la hidrolisis del colágeno mediante tratamientos térmicos y enzimáticos. Se utilizaron siete diferentes enzimas: Heliozym (He), Propain (Pro), Curtizyme (Cur), Coctel (Ck), Fungal (Fu), Rohapon (Roh) y polizym (Po), además de dos controles (con y sin tratamiento térmico ). Se determinó el efecto en la viscosidad, propiedades térmicas y contenido de hidroxiprolina para establecer cual enzima desarrollo de una manera más óptima el hidrolizado del colágeno ovino. La hidrolisis del colágeno se realizó a una temperatura de 50°C por un periodo de 24 horas. El mejor desempeño de hidrólisis fue el tratamiento Po al presentar diferencias significativas (P ≤ 0.05) con menor viscosidad. Las propiedades térmicas reportaron que el hidrolizado He desarrolló menor entalpía durante la fase de desnaturalización sugiriendo que se obtuvo una tamaño de cadena menor comparado con los otros hidrolizados. Sin embargo, el tratamiento Fu reportó mayor cantidad de hidroxiprolina con un promedio de 12.65 mg/ml. Se observó una tendencia proporcional entre los diferentes parámetros evaluados debido a que los tratamientos con mayor viscosidad reportaron también valores altos en hidroxiprolina y propiedades térmicas más estables.
Palabras clave: colágeno hidrolizado, tratamiento térmico-enzimatico, hidroxiprolina, propiedades térmicas, viscosidad
Abstract
In the present work, collagen hydrolysis was carried out by thermal and enzymatic treatments. Seven different enzymes were used: Heliozym (He), Propain (Pro), Curtizyme (Cur), Cocktail (Ck), Fungal (Fu), Rohapon (Roh) and polizym (Po), plus two controls (with and without treatment thermal). The effect on the viscosity, thermal properties and content of hydroxyproline was determined in order to establish which enzyme the ovine collagen hydrolyzate developed in a more optimal way. Collagen hydrolysis was performed at a temperature of 50 ° C for a period of 24 hours. The best hydrolysis performance was the Po treatment when presenting significant differences (P ≤ 0.05) with lower viscosity. The thermal properties reported that the He hydrolyzate developed lower enthalpy during the denaturing phase suggesting that a smaller chain size was obtained compared to the other hydrolysates. However, the Fu treatment reported a greater amount of hydroxyproline with an average of 12.65 mg / ml. A proportional trend was observed between the different parameters evaluated because the treatments with higher viscosity also reported high values in hydroxyproline and more stable thermal properties.
Keywords: hydrolyzed collagen, thermal-enzymatic treatment, hydroxyproline, thermal properties, viscosity
Introducción
El colágeno es la principal proteína estructural de los diversos tejidos conectivos en animales tales como ligamentos, huesos, y pieles [1]. Hay por lo menos 19 variantes de colágeno, denominados tipo I-XIX. Tipos I, II, III Y V son el colágeno fibroso. El colágeno tipo I se encuentra en todos los tejidos conectivos, incluyendo huesos y pieles. Es un heteropolímero de dos cadenas α1 y α2. Se compone de un tercio de glicina, no contiene triptófano o cisteína y es muy baja en tirosina e histidina [2]. El uso del sistema enzimático es dado a su potencial catalítico, y su alta especificidad bajo condiciones optimas de temperatura, presión y pH [3].
La hidrolisis parcial de una proteína, realizada por medio de ácidos, bases o enzimas conduce a la obtención de moléculas más pequeñas [4]. La proteólisis enzimática ha demostrado la solubilidad, emulsión y liberación de péptidos biológicamente activos del colágeno [5]. El colágeno y sus hidrolizados a partir de piel animal y cueros se producen por hidrolisis térmica y enzimática controlada. Sin embargo se prefiere la hidrolisis enzimática, ya que produce el material en su estado nativo [6]. Por lo tanto, el presente trabajo tuvo como objetivo hidrolizar el colágeno y evaluar el efecto enzimático.
Metodología
Materia prima
Se realizo la extrcción de colageno de la piel de borrego pelibuey, piel colectada en Tulancingo de Bravo Hidalgo.
Diseño experimental
La hidrolisis del colágeno ovino tipo I se llevó a cabo en un baño de temperatura constante Scorpion Scientific modelo A506501 con periodo de tiempo de 24 horas a una temperatura de 50°C. Obtenidas las muestras hidrolizadas se determinó viscosidad con el viscosímetro Brookfiel modelo RVTnt AR200 la cual se realizó por la metodología [7], los resultados fueron expresados en mPa*S. Las propiedades térmicas se determinaron con calorímetro de la marca TA instrument DSC Q 2000 se llevó a cabo por el método desarrollado por [8]. Para el contenido de hidroxiprolina y colágeno se llevó a cabo en un espectrofotómetro Jenway 6715 UV/Vis, mediante la metodología [9]. Los resultados obtenidos se expresaron en mg/ml de acuerdo a la curva de calibración obtenida para la concentración de hidroxiprolina (0, 5, 10, 15 y 20 mg ).
Viscosidad
Se realizó mediante la metodología de Yu, Chi et al., 2014 [2]. Se utilizaron muestras sin dializar determiando su viscosidad. Se tomó 200 mL del extracto de colageno previamente a 4°C. Cada muestra fue colocada para su lectura en el viscosímetro Brookfiel modelo RVTnt AR200 con un spindle 02 a una velocidad de 100 haciendo tres lecturas por minuto. Los resultados obtenidos, se expresaron en milipascales por segundo (mPa*S).
Calorimetrìa diferencial de barrido
Se realizó mediante el método de Badii y Howell, 2003 [9] con ligeras modificaciones. La muestra de colágeno empleada para esta prueba fue previamente sometida a un proceso de secado en liofilizador a
-0.85 Ba. Se colocaron 1.00 mg de colágeno hidrolizado en una charola y fueron prensadas, sus propiedades térmicas fueron evaluadas en un calorímetro de la marca TA instrument DSC Q 2000 de la marca Felisa, modelo 242ª. Se realizó un barrido de temperatura en cada muestra de 10o C a 200 o C con una velocidad de calentamiento de 10o C por minuto. Los resultados obtenidos, se expresaron en W/g.
Contenido de hidroxiprolina
Se realizó por la metodología por Neuman y Logan, 2011 [10]. La muestras empleadas para esta determinación fueron previamente liofilizadas.Se colocaron 0.2 gramos de cada muestra seca en su resp|ectivo tubo de digestión previamente etiquetado, se agregó a cada tubo 5 mL de ácido clorhídrico al 50 % e inmediatamente se aislaron del medio externo por medio de un tapón de rosca. Posteriormente, los tubos fueron colocados en una gradilla y a su vez, la gradilla con los tubos de digestión fue colocada en un horno a 100 °C por un periodo de 16 horas. Cumplidas las 16 horas y los tubos de digestión aclimatados a temperatura ambiente, el líquido dentro de los mismos fue transferido a matraces volumétricos de 100 mL previamente etiquetados. Es importante mencionar que los matraces volumétricos contenían 40 mL de agua destilada con la finalidad de acondicionar la muestra. Se realizaron múltiples enjuagues por tubo de digestión con la misma agua destilada que fue utilizada para aforar el matraz volumétrico, por lo tanto, se hicieron tres múltiples enjuagues.
Se obtuvieron tres muestras y se tomaron 4mL de cada matraz volumétrico y se vertieron en su respectivo matraz volumétrico de 100 mL previamente etiquetado y se aforaron con agua destilada. Las muestras pasaron por una etapa de filtración con la finalidad de eliminar los residuos carbonizados resultantes a partir de la digestión de las muestras secas, antes de que se tomaran los 2 mL de cada matraz volumétrico.
Posteriormente, se tomó una alícuota de 2 mL de cada matraz volumétrico para verterlos en seis matraces volumétricos de 25 mL, de los 4 mL anteriormente mencionados se tomaron 2 mL para verterlos en un matraz volumétrico de 25 mL al igual que los otros 2 mL, esto se hizo para las tres muestras que anteriormente se llamaron “muestras listas”. Una vez vertida la muestra lista en los matraces volumétricos se agregaron 2 mL de una solución de Sulfato de Cobre II (CuSO4) al 0.05 mol/L seguido de 2 mL de una solución de Hidróxido de Sodio al 1.25 mol/L y finalmente 2 mL de una solución de Peróxido de Hidrógeno al 6 % (tengo que citar, que es recomendable que la solución de Peróxido de Hidrógeno se elabore en el momento en el que se va a utilizar). Es importante mencionar que los matraces volumétricos deben estar destapados.
Después, cada matraz volumétrico se agito gentilmente una vez por minuto durante cinco minutos, en seguida, los matraces volumétricos fueron colocados en un baño de agua a 40 °C por un periodo de tiempo de 15 minutos con la finalidad de retirar el exceso de Peróxido de Hidrógeno. Culminado el tiempo de calentamiento, los matraces se enfriaron a temperatura ambiente para después agregarle a cada uno de ellos 10 mL de Ácido Sulfúrico al 0.9 mol/L seguido por 5 mL de una solución de dimetilaminobenzaldehido que está a una concentración del 5 %. Es importante mencionar que se utilizó acetona de grado reactivo como solvente del dimetilaminobenzaldehido.
Los matraces fueron colocados nuevamente en un baño de agua pero ahora a 70 °C durante un periodo de tiempo de 30 minutos, transcurrido el tiempo antes mencionado la solución dentro de los matraces volumétricos presento una coloración rosa muy tenue. Posteriormente, los matraces volumétricos fueron enfriados con la ayuda de agua fría hasta alcanzar la temperatura ambiente, finalmente se aforaron los matraces volumétricos con agua destilada y se procedió a hacer la medición de la absorbancia contra un blanco a una longitud de onda de 555 nm. El desvanecimiento del color es insignificante durante un periodo de tiempo de 45 minutos. Se trazó un gráfico de la absorbancia contra la concentración de hidroxiprolina previamente realizada con las siguientes concentraciones de hidroxiprolina (hidroxy-L-proline de Sigma Aldrich); 0 mg, 5 mg, 10 mg, 15 mg y 20 mg. El procedimiento fue el mismo al descrito anteriormente. Las absorbancias obtenidas se correlacionaron con la curva patrón para saber la concentración desconocida de hidroxiprolina presente en las muestras liofilizadas.
Análisis estadístico
Los datos se analizaron con el programa SPSS. Se hizo un diseño completamente al azar, como se presentaron diferencias significativas (P <0.05) se realizó una comparación de medias Tukey.
Resultados
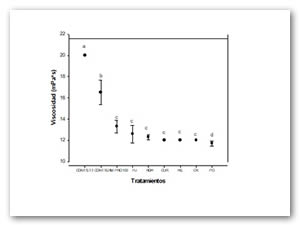
En la figura 1 se presentan los tratamientos que fueron sometidos a tratamiento térmico (50 ªC) e hidrolisis enzimática excepto el control que en este caso es el colágeno nativo. Se observan diferencias significativas (P ≤ 0.05) del colágeno nativo sin tratamiento térmico muestra un volumen hidrodinámico mayor porque presenta una mayor resistencia a fluir esto con respecto al control que si llevo un tratameinto térmico y enzimático; estos resultados sugieren que el tratamiento térmico al que fue sometida la muestra provocó la desnaturalización del colágeno y el tratamiento enzimático la ruptura de los polipéptidos. Los tratamientos térmicos- enzimáticos sometidas a las mismas condiciones de temperarura con Pro 100 ( 13.3 cps), Fu ( 12.6 cps), Roh (12.29), Ck (12), Cur (12 cps), He (12 cps), Po (11.7 cps) presentan una tendencia a reducir la viscosidad; estos resultados son congruentes con trabajos previos Denis et al., 2008 en donde mostraron que el rango de viscosidades medibles es entre 2 y 26 mPa*S.
En la Figura 2 Se observa que de acuerdo al tratamiento térmico-enzimatico la cantidad de hidroxiprolina cambia. Para el caso del colageno nativo la cantidad de hidroxiprolina es mayor con respecto a los otros tratamientos. Se observan diferencias significativas (P ≤ 0.05). Estos resultados sustentan lo reportado por Ramachandran et.al., 1973 en donde señalan que la hidroxiprolina desempeña una función importante en la estabilidad de la triple hélice del colágeno.
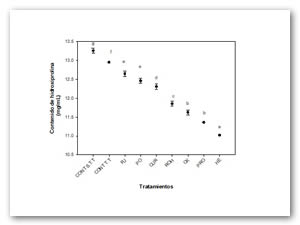
Figura 2. Contenido de hidroxiprolina en función del tipo de enzima
utilizado en la hidrólisis de colágeno.
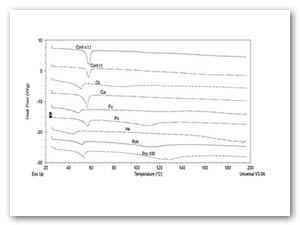
La Figura 3 muestra los resultados de las propiedades térmicas del colágeno Se observa que la conformación estructural del control sin tratamiento térmico ( colágeno nativo) esta más organizada y el control con tratamiento térmico-enzimatico esta más desorganizada, se observan diferencias significativas (P ≤ 0.05). El pico tiende a desaparecer conforme la intensisad de la hidrolisis. Para el caso de la enzima Heliozym con una viscosidad menor con respecto a los otros tratameintos presenta un grado de desorganización menor es por ello que no requiere de mucha energía para la desnaturalización.
(Gunda, Verma, & C.Sudhakar, 2014, mencionan que la estabilidad térmica del colágeno se debe a las interacciones de las cadenas de colágeno por medio de enlaces por puente de hidrogeno principalmente a través del grupo hidroxilo de la hidroxiprolina del colágeno.
Su et al., 2012 mencionan que el proceso de desnaturalización en el colágeno es irreversible, ya que al final de este proceso se pierde la estructura helicoidal de la triple hélice que caracteriza al colágeno .
Conclusiones
El tiempo de proteólisis, la concentración de enzima y el tipo de enzima son factores significativos para lograr la disminución de la viscosidad, las propiedades térmicas y el contenido de hidroxiprolina presentes en la muestra. El tratamiento con la enzima He muestra un valor de viscosidad menor y en las propiedades térmicas el grado de desorganización del mismo requiere menor absorción de energía así como el contenido de hidroxiprolina disminuyo dado a que el tamaño de la cadena es menor y por consecuencia la hidrolisis es más efectiva.
Referencias
1. Kim, Soo Hyeon, Park, Hae Sang, Lee, Ok Joo, Chao, Janet Ren, Park, Hyun Jung, Lee, Jung Min, Park, Chan Hum., “Fabrication of duck’s feet collagen–silk hybrid biomaterial for tissue engineering”, International Journal of Biological Macromolecules, 85, 442-450, 2016.
2. Muyonga, J. H., Cole, C. G. B., & Duodu, K. G.,“Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)”,Food Chemistry, 85(1), 81-89, 2004.
3. Choudhary, RB, Jana, AK, & Jha, MK.,“Enzyme technology applications in leather processing”, Indian Journal of chemical technology, 11, 659-671,2004.
4. Girón González, María Dolores, & Salto González, Rafael, Bioquímica Estructural, 2014-2015.
5. Huo, Jian-xin, & Zhao, Zheng., “Study on Enzymatic Hydrolysis of Gadus morrhua Skin Collagen and Molecular Weight Distribution of Hydrolysates”, Agricultural Sciences in China, 8(6), 723-729, 2009.
6. Selvakumar, Pitchaivelu, Ling, Tau Chuan, Covington, Anthony D., & Lyddiatt, Andrew., “Enzymatic hydrolysis of bovine hide and recovery of collagen hydrolysate in aqueous two-phase systems”, Separation and Purification Technology, 89, 282-287, 2012.
7. Yu, Di, Chi, Chang-Feng, Wang, Bin, Ding, Guo-Fang, & Li, Zhong-Rui.(Núnez)., "Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis)", Chinese Journal of Natural Medicines, 12(9), 712-720, 2014.
8. Badii, Farah, & Howell, Nazlin K., "Elucidation of the effect of formaldehyde and lipids on frozen stored cod collagen by FT-Raman spectroscopy and differential scanning calorimetry", Journal of Agricultural and Food Chemistry, 51(5), 1440-1446, 2003.
9. Neuman, Robert. E, & Logan, Milan, A., "The determination of collagen and elastin in tissues", Journal of Biological Chemistry, 186(2), 549-556, 1950.
10. Denis, Alain, Brambati, Noëlle, Dessauvages, Bernadette, Guedj, Sylviane, Ridoux, Claude, Meffre, Nicole, & Autier, Claude., “Molecular weight determination of hydrolyzed collagens”, Food Hydrocolloids, 22(6), 989-994, 2008.
11. Ramachandran, GN, Bansal, M, & Bhatnagar, RS., “A hypothesis on the role of hydroxyproline in stabilizing collagen structure”, Biochimica et Biophysica Acta (BBA)-Protein Structure, 322(1), 166-171, 1973.
12. Su, Dihan, Wang, Chunhua, Cai, Sumei, Mu, Changdao, Li, Defu, & Lin, Wei., “ Influence of palygorskite on the structure and thermal stability of collagen, Applied Clay Science, 62, 41-46, 2012.
[a] Profesor - Investigador del Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, carmen_0511@hotmail.com
[b] Profesor - Investigador del Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, ruben_jimenez@uaeh.edu.mx
[c] Profesor - Investigador del Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, victormj@uaeh.edu.mx
[d]* Profesor - Investigador del Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, aguirre@uaeh.edu.mx