En el presente trabajo se realizó la licuación de la miel con ultrasonido y se determinó su efecto en los compuestos bioactivos y sus propiedades antioxidantes. Se evaluaron mieles cristalizadas de cinco municipios del Estado de Hidalgo como el Arenal (multifloral), Acaxochitlán (multifloral), Huehuetla (multifloral), Orizatlán (monofloral) y Tasquillo (mielada). Para la licuación de las mieles se utilizó un baño ultrasónico Branson 3510 con una frecuencia de 42KHz y periodos de tiempo de 5, 10 y 15 minutos a una temperatura de 20°C. Los parámetros fueron: fenoles totales y actividad antioxidante por (ABTS). La licuación presento diferencias significativas (p < 0.05) en fenoles totales así como en la actividad antioxidante medida como ABTS. Presentando en algunas mieles un incremento de los compuestos bioactivos y sus propiedades antioxidantes.
Palabras clave: Miel, actividad antioxidante, compuestos fenólicos
In the present research was realized the liquefaction of honey using ultrasound and was determined its effect in the bioactive compounds and antioxidant properties. Crystallized honey of five cities of the Estado de Hidalgo: 1)Arenal (multifloral), 2) Acaxochitlan (multifloral), Huehuetla (multifloral), Orizatlan (monofloral) y Tasquillo (honeydew). For the ultrasound was employed a ultrasonic bath Branson 3510 with a 42KHz frequency and with time periods of 5, 10 and 15 minutes at 20°C of temperature. The parameters evaluated were: total phenolic compounds and antioxidant activity using the ABTS method. After the liquefaction the honeys present a statistic difference (p < 0.05) in the totel phenolic compound and antioxidant activity. In some honeys was observed a increasing in this parameters.
Keywords: Honey, antioxidant activity, phenolic compounds
La miel es un alimento natural producido por las abejas (Apis mellífera L.) a partir del néctar de las flores y de secreciones de la planta, que las abejas recogen, transforman, combinan con sustancias específicas propias y almacenan en panales, de los cuales se extrae el producto sin ninguna adición [15] Es una solución de azúcar sobresaturada, su composición depende de las especies de plantas polinizadas por las abejas y las condiciones climáticas, de procesamiento y almacenamiento [1]. De acuerdo a su composición se clasifica en florales, monoflorales, multiflorales y mieladas. La miel es conocida por ser rica en antioxidantes, incluyendo los flavonoides, ácidos fenólicos, derivados de carotenoides, ácidos orgánicos, aminoácidos y proteínas [7],[10],[16]. Los antioxidantes identificados en diferentes mieles han demostrado ser eficaz en la reducción del riesgo de enfermedades del corazón, cáncer, declinación del sistema inmune, cataratas, y diferentes procesos inflamatorios [10]. La miel es altamente viscosa, a menudo sobresaturada y susceptible a la cristalización. La granulación espontánea puede dar lugar a cristales secundarios no deseados y puede causar pérdida de calidad debido a la separación de fases, sedimentación y aumento de la actividad del agua [6]. La menor solubilidad de la glucosa permite ser la cristalización del azúcar. La glucosa puede cristalizar como monohidrato α- D –glucosa con la forma cristalina estable por debajo de 50°C, como anhidro α- D –glucosa entre 50 y 80°C [8]. La cristalización de la miel por lo general resulta en un aumento de la humedad de la fase líquida, lo que hace que la miel sea vulnerable a crecimiento de la levadura lo que puede causar fermentación del producto que con el tiempo produce modificaciones organolépticas posteriores y degrada la calidad, también causa problemas durante la manipulación y el procesamiento [19],[20],[21]. Aunque la miel cruda es lo mejor, en las industrias se lleva acabo el calentamiento de esta ya que es el único método práctico para facilitar el llenado debido a su viscosidad, este proceso igualmente se utiliza para la licuación de la miel cuando se encuentra cristalizada [4], sin embargo la aplicación de un tratamiento térmico puede destruir algunos compuestos como bionutrientes y vitaminas [19].
Tecnologías alternativas tales como ultrasonidos, se han estudiado en el pasado, reportando que las ondas sonoras de baja frecuencia (9, 18, 23 y 24 kHz, respectivamente) eliminan los cristales existentes y retardan la cristalización posterior [9]. También revelaron que el sonido de alta frecuencia destruye la levadura, mejora la apariencia, e inhibe la granulación del producto [14].
El tratamiento con ultrasonido se puede utilizar para el proceso de licuación de la miel [18]. Por lo que el presente trabajo tuvo como objetivo licuar la miel con ultrasonido, evaluar el efecto que presentaba en los compuestos bioactivos y propiedades antioxidantes, ya que es importante consérvalos porque son una fuente significativa para el buen funcionamiento del cuerpo humano.
Materia prima
Se analizó miel cristalizada de cinco municipios del Estado de Hidalgo como el Arenal (multifloral), Acaxochitlán (multifloral), Huehuetla (multifloral), Orizatlán (monofloral) y Tasquillo (mielada).
Diseño experimental
Se pesaron 15 gramos de miel en tres tubos de ensaye de las cinco mieles y se colocaron en un baño ultrasónico Branson 3510 a una frecuencia de 42 KHz con periodos de tiempo de 5, 10 y 15 minutos a una temperatura de 20°C.
Fenoles totales
Se realizó mediante la metodología de Folin- Ciocalteau, Singleton et al., 1999 [17]. Se pesaron 5 g de miel y se adicionaron 50 mL de agua destilada, posteriormente se filtró con papel Whatman No.1. Se tomaron 0.5 mL de la muestra filtrada y se colocaron en tubos de ensaye cubiertos con papel aluminio, la muestra fue mezclada con 2.5mL del reactivo diluido (1:10) de Folin-Ciocalteau 0.2N (Sigma Aldrich, USA) se dejaron reposar por 5 min, transcurrido en tiempo se adicionaron 2mL de la solución de carbonato de sodio al 7.5% hasta lograr una mezcla homogénea. Después se dejó reposar durante 2 horas y finalmente se leyó la absorbancia de la mezcla en un espectrofotómetro (Varian CARY 100BIO, Italia) a una longitud de onda de 760nm. Los resultados obtenidos, se expresaron en miligramos de equivalentes de ácido gálico (mg EAG/100g miel) de acuerdo a la curva de calibración obtenida para el ácido gálico en concentraciones de 0-100 mg/L.
Actividad Antioxidante ABTS
Se realizó por la metodología por Re et al., 1999 [13]. El reactivo ABTS se disolvió en agua a una concentración 7 mM, el catión radical ABTS fue producido mediante la reacción de la solución madre de ABTS con persulfato de potasio (2.45 mM), la mezcla se mantuvo en agitación constante y a temperatura ambiente en la oscuridad en un periodo de tiempo de 16 a 24 horas antes de su uso. Una vez formado el radical ABTS se diluyó con etanol al 20%, hasta alcanzar una absorbancia comprendida entre 0,7 ± 0.01 a 734 nm. Se midió la absorbancia inicial y posteriormente se agregó 100 μL del extracto de miel, se agito rápidamente y se midió el cambio de absorbancia a los 10 min de la reacción. Se calculó la actividad antioxidante usando una curva estándar de ácido ascórbico (0-95mg EAA/L), los resultados fueron expresados en mg EAA/100gmiel.
Análisis estadístico
Los datos se analizaron con el programa NCSS 7. Se hizo un diseño completamente al azar, como se presentaron diferencias significativas (P <0.05) se realizó una comparación de medias Tukey.
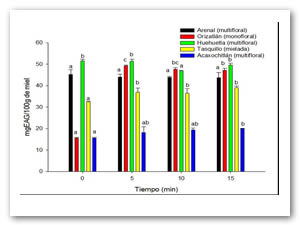
La Figura 1 muestra el efecto del ultrasonido en fenoles totales, las mieles de Orizatlán, Tasquillo y Acaxochitlán presentan efecto significativo (p<0.05), mientras que la miel del Arenal no presento diferencias significativas (p˃0.05). Se puede observar que la miel de Orizatlán presentó un incremento de más de tres veces en el contenido de fenoles totales.
Pittaya & Pattaneeya 2015, mostraron que los fenoles totales, flavonoides totales y capacidad antioxidante en mieles tratadas con ultrasonido a 20 kHz y 20-60% amplitudes de 5-20 min aumentaron presentando diferencias significativas (P˂0.05) en comparación con la muestra sin tratamiento, por lo tanto podemos observar que los resultados obtenidos presentan similitud con estos autores ya que las muestras tratadas con ultrasonido incrementaron su contenido en fenoles totales.
Figura 1: Efecto de ultrasonido en contenido de fenoles totales de mieles del Estado de Hidalgo
La Figura 2 muestra los resultados de la actividad antioxidante por ABTS encontrando diferencias significativas (p<0.05) en las mieles de Orizatlan, Huehuetla, Acaxochitlán y Tasquillo, aumentando su actividad antioxidante.
Pittaya & Pattaneeya 2015, mencionan que una posible explicación para el aumento observado en los niveles la actividad antioxidante en la miel, es la desintegración del polen debido a la estimulación ultrasónica.
Figura 2: Efecto de ultrasonido en la actividad antioxidante por radical ABTS en mieles del Estado de Hidalgo
El efecto del ultrasonido en los compuestos bioactivos y propiedades antioxidantes de la miel va a depender del origen botánico.
El ultrasonido es una tecnología que puede ser utilizada para la licuación de la miel ya que no disminuye a los compuestos bioactivos ni las propiedades antioxidantes y en algunas mieles hasta los incrementan. Así mismo es una alternativa para evitar el calentamiento ya que por medio de este proceso tiende a perder propiedades como los bionutrientes.
[1] Ajlouni, S., Sujirapinyokul, P., “Hydroxymethylfurfuraldehyde and amylase contents in Australian honey”, Food Chemistry, 119, 3, 100-1005, 2009.
Ammar Altemimi, Ruplal Choudhary, Dennis G. Watson, David A. Lighfoot, “Effects of ultrasonic treatments on the polyphenol and antioxidant content of spinach extracts”, Ultrasonic Sonochemeistry, Ultrasonics Sonochemistry, 24, 247-255, 2015.
Arvouet-Grand, A., Vennat, B., Pourrat, A.,Lergret, P., “Standardisation dun extrait de propolis et identification des principaux constituants”, J. Pharm. Belgique, 49, 462-468, 1994.
[4] Bath, P. K., & Singh, N., “A comparison between Helianthus annuus and Eucalyptus lanceolatus honey”, Food Chemistry, 67,389–397, 1999.
Brand-Williams, W., Cuvelier, M. E., Berset, C., “Use of a free radical method to evaluate antioxidant activity”, Lebensmittel Wissenschaft und Technologie, 28, 25-30, 1995.
[6] Elena Venir, Massimiliano Spaziani, Enrico Maltini., “Crystallization in Tarassaco Italian honey studied by DSC”, Food Chemistry, 122, 410-415, 2010.
[7] Gheldof, N., Wang, X. H., & Engeseth, N. J., “Identification and quantification of antioxidant components of honeys from various floral sources”, Journal of Agricultural and Food Chemistry, 50, 5870–5877, 2002.
[8] Gleiter, R. A., Horn, H., Isengard, H. D., “Influence of type and state of crystallization on the water activity of honey”, Food Chemistry, 96, 3, 441–445, 2006.
[9] Kalogereas, T., “Preliminary report on the effect of ultrasonic waves on the crystallisation of honey”, Journal of Food Science, 121, 339–340, 1995.
[10] Lachman, J., Orsak, M., Hejtmankova, A., & Kovarova, E., “Evaluation of antioxidant activity and total phenolics of selected Czech honeys”, LWT–FoodmScience and Technology, 43, 52–58, 2010.
Nunta,R. & Intipunya ,P, “Meltingof crystallized sun flower honey by high power ultrasonic method”, Food and Applied Bioscience Journal, 1, 24–33, 2013.
Pittaya Chaikhaman, Pattaneeya Prangthipb, “Alteration of antioxidative properties of longan flower-honey after high pressure, ultrasonic and thermal processing”, Food Biocience, 10, 1-7, 2015.
Re. R., Pellegrini. N., Proteggente. A., Pannala. A., Yang. M. Rice Evans, “Antioxidant activity applying an improved ABTS radical action decolonization assay free Radical”, Biology and Medicine, 26; 1231-1337, 1999.
[14] Rokhina E.V., Lens P., Virkutyte J., “Low-frequency ultrasound in biotechnology: state of the art”, Trends in Biotechnology, 27 (5), 298–306, 2009.
[15] Sáenz Laín C, Gómez Ferreras C., “Características e identificación mediante el análisis de polen”, Mieles Españolas, Editorial Mundi-Prensa España, pp 105, 2000.
[16] Schramm, D. D., Karim, M., Schrader, H. R., Holt, R. R., Cardetti, M., & Keen, C. L., “Honey with high levels of antioxidants can provide protection to healthy human subjects”, Journal of Agricultural and Food Chemistry, 51, 1732–1735, 2003.
[17] Singleton, V. L.; Orthofer, R.; Lamuela-Raventos, R. M., “Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu Reagent”, Methods in Enzymology, 299, 152-178, 1999.
[18] Thrasyvoulou A., Manikis J., Tselios D., “Liquefying crystallized honey with ultrasonic waves”, Apidologie, 25, 297-302, 1994.
[19] Tosi E., Ciappini M., Re E., Lucero H., “Honey thermal treatment effects on hydroxymethylfurfuralcontent”, Food Chemistry, 77, 71–74, 2002.
[20] Tosi E., Martinet R., Ortega M., Lucero, H., Ré E., “Honey diastase activity modified by heating”. Food Chemistry 106 3, 883–887, 2008.
[21] Turhan Irfan, T.N., Mustafa, Karhan, Fehmi, Gurel, ReyhanTavukcuoglu, H., “Quality of honeys influenced by thermal treatment”, LWT – Food Science and Technology, 41 (8), 1396–1399, 2008.
[a] Área de Ing. Agroindustrial e Ing. en Alimentos del ICAP de la Universidad Autónoma del Estado de Hidalgo.
[b]Área Departamental de Engenharia Alimentar, Escola Superior de Tecnologia, Universidade do Algarve, Campus da Penha Faro, Portugal .