En este trabajo se evaluó el efecto de adicionar microcápsulas de xoconostle (Opuntia oligacantha) a una matriz polimérica comestible, en las propiedades antioxidantes. Se utilizaron 3 concentraciones de pulpa libre; 0.4, 0.8 y 1.2 g, y 3 concentraciones de pulpa encapsulada 0.4, 0.8 y 1.2 g, además de un blanco. El mejor tratamiento fue la película con 1.2 g de encapsulado (54.12±0.77 mgEAG/100g para fenoles totales, 29.11±0.48/100g mgEAA para ABTS, 41.42±1.81 mgEAA/100g para DPPH). Las películas adicionadas con microencapsulado de xoconostle presentan una actividad antioxidante superior que las adicionadas con pulpa.
Palabras clave: películas comestibles, xoconostle, microencapsulado, actividad antioxidante
In this research was evaluated the effect of the antioxidant properties of a comestible polymeric matrix added with xoconostle (Opuntia oligacantha) microencapsulated. For the experiment design was elaborated different comestible films using three concentration of free xoconostle pulp (0.4, 0.8 and 1.2 g) and three concentration of xoconostle microencapsulated pulp (0.4, 0.8 and 1.2 g), also was employed negative control. The best treatment was the film elaborated with 1.2 g of the pulp microencapsulated obtained in phenolic compounds 54.12±0.77 mgEAG/100g and in antioxidant capacity 29.11±0.48/100g mgEAA with ABTS and 41.42±1.81 mgEAA/100g with DPPH. The comestible films added with xoconostle microencapsulated showed a higher antioxidant activity than the films added only with the free xoconostle pulp.
Keywords: comestible films, xoconostle, microencapsulated, antioxidant activity
Aunque muchos tipos de nuevos polímeros se producen industrialmente (PLA, PHA, PCL, PEA y otros), los polímeros utilizados en la agricultura son los más estudiados por los investigadores, especialmente los polisacáridos. Entre las películas a base de polisacáridos, las obtenidas a partir de almidón son las más importantes, ya que es una de las materias primas agrícolas más utilizadas, es una fuente renovable, barata y ampliamente disponible [1]. Más allá de esto, tiene buenas propiedades de formación de película.
El chayotextle es la parte más nutritiva de la planta del chayote, corresponde a las raíces tuberizadas que contienen de 10 a 25 % de almidón [2]. La raíz tuberizada o rizoma es “largo, amorfo, macizo” y presenta un tejido tuberoso con sabor a vegetal que, probablemente, se parte cuando ya está vieja y fibrosa [3].
Las tendencias actuales incluyen el desarrollo de materiales de embalaje, que interactúan con el producto. Una de las varias posibilidades, que están siendo estudiadas ampliamente, es la incorporación de sustancias activas en el material del paquete [4].
El fruto del cactus Opuntia joconostle, conocido como xoconostle, se utiliza como condimento en la cocina mexicana, y en la elaboración de dulces, jaleas y bebidas. La fruta tiene pericarpio color rosado, mesocarpio suculento de color amarillo hasta rosado, y un endocarpio de color rojo profundo que contiene pequeñas semillas de color marrón [5].
La cáscara, pulpa y el endocarpio del O. joconostle podrían considerarse como un objetivo atractivo para la industria alimentaria, respecto a su composición nutricional así como sus propiedades antioxidantes. Estudio anteriores concluyen O. joconostle es una buena fuente de compuestos fenólicos, flavonoides y tocoferoles, que proporcionan una buena capacidad antioxidante [6]. Por tanto, la pulpa principalmente de las variedades más consumidas, puede ser considerada como alimento funcional [7].
El objetivo del trabajo fue determinar la capacidad antioxidante de las películas a base de almidón de chayotextle adicionadas con xoconostle encapsulado.
El fruto de Xoconostle utilizado fue de la variedad Opuntia oligacantha, cosechado en el municipio de Tezontepec de Aldama, Hidalgo, México. Se realizó una extracción de la pulpa del fruto, posteriormente se llevó a un 30% de solidos con una mezcla de maltodextrina-goma arábiga (material de pared) y se secó por aspersión en un en un mini Spray Dryer (Büchi B-290, Suiza), manteniendo las siguientes condiciones de secado: temperatura de entrada de 160°C, 4 bares de presión y 10 mL/ min de flujo de entrada [8]. Las microcápsulas se almacenan en bolsas selladas color ámbar y en refrigeración hasta el momento de su análisis.
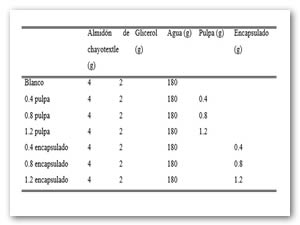
El almidón fue aislado de acuerdo a lo descrito por Flores-Gorosquera et al. [9]. Las películas se realizaron siguiendo la metodología de Aila-Suárez et al., [10] con algunas modificaciones. 4 g de almidón de chayotextle se mezclan con 180 ml de agua y 2g de glicerol. Llevando a una temperatura de 90°C. Pasado el tiempo correspondiente la solución filmogénica se vertió en una placa recubierta con teflón y se secó en estufa 24 h a 35°C.
En el tiempo de enfriado antes del vertido en placa de adicionó tanto pulpa como encapsulados según fue el caso. Obteniendo así los siguientes tratamientos:
Determinación de fenoles totales.
Se utilizó el método espectrofotométrico desarrollado por Folin y Ciocalteau [11], y descrito por Waterman et al., [12] para la determinación de fenoles totales las muestras se leyeron a 760 nm. Los resultados se expresan en mg de ácido gálico por 100g de pulpa de frutos.
Determinación de actividad antioxidante por DPPH.
Este método se basa en la reducción de la absorbancia del radical DPPH [13], por antioxidantes. Se tomó lectura de la absorbancia a una longitud de onda de 515 nm. El resultado fue expresado en mg de ácido ascórbico por 100g de pulpa de frutos.
Determinación de actividad antioxidante por ABTS.
Según la metodología desarrollada por Re et al., [14] y descrita por Kuskoski et al. [14], el radical ABTS. La absorbancia se tomó a una longitud de onda de 734 nm. Los resultados fueron expresados en mg de ácido ascórbico / 100gde muestra.
Análisis estadístico
Se utilizó un diseño completamente al azar. Los resultados fueron analizados por un ANOVA cuando existieron diferencias significativas (P<0.05); se utilizó la prueba de comparación de medias Tukey.
Es bien sabido que la actividad antioxidante es derivada primordialmente por compuestos polifenólicos, los cuales son altamente efectivos como captadores de radicales libres y antioxidantes, es por eso que existe una elevada correlación entre los fenoles totales y la actividad antioxidante [15]. La figura 1 muestra el resultado de fenoles totales, donde se observa que la concentración menor se encuentra en la película blanco (24.51±0.44 mgEAG), siendo la película con 1.2 g de encapsulado la concentración más elevada de fenoles totales (54.12±0.77 mgEAG). Wang et al., [16] elaboraron películas de quitosano adicionadas con diferentes concentraciones de polifenoles de té. Determinando que estos compuestos quedan inmersos en la matriz polimérica en relación con la cantidad adicionada de extracto presentándose un decremento con respecto al tiempo. El uso de compuestos fenólicos naturales en el envasado de alimentos ha sido particularmente alentado porque los mejoran contra la oxidación y contra microorganismos y ofrecen beneficios a la salud humana. Además, estos compuestos tienen un efecto plastificante, con lo que las películas pueden ser más flexibles [17].
Figura 1. Contenido de fenoles totales en películas de almidón de chayotextle adicionadas con pulpa y microcápsulas de xoconostle
Figura 2. Actividad antioxidante (ABTS) en películas de almidón de chayotextle adicionadas con pulpa y microcápsulas de xoconostle
Un comportamiento similar puede observarse en la figura 2 donde la menor actividad antioxidante mediante la inhibición del radical ABTS+ se obtuvo en la película blanco (0.99±0.30 mgEAA/100g) La máxima concentración para ABTS fue para la película 1.2 encapsulado (29.11±0.48 mgEAA/100g). De acuerdo con Moradi et al., [18] el grado de poder antioxidante en películas comestibles es generalmente proporcional a la cantidad agregada de aditivo antioxidante. Tal como lo descrito por Montanheiro Noronha et al., [19] en películas de metilcelulosa adicionadas con nanocápsulas de tocoferol, los valores reportados para actividad antioxidante por ABTS van en función de la concentración adicionada de nanocápsulas.
Figura 3. Resultado de DPPH en películas de almidón de chayotextle adicionadas con pulpa y microcápsulas de xoconostle
La figura 3 muestra el resultado obtenido para la actividad antioxidante mediante la inhibición del radical DPPH+, donde se observa que entre las películas que fueron adicionadas con pulpa libre de xoconostle no existen diferencias significativas (p<0.05), este comportamiento puede asociarse a una interacción de los compuestos fenólicos con la matriz polimérica de amilosa, resultando en un comportamiento similar a lo reportado por Serrano et al., [20], en interacciones de compuestos fenólicos con fibra dietaria. Donde el complejo grupo de polisacáridos que forman a la fibra puede actuar atrapando compuestos fenólicos o bien formando interacciones químicas con ellos. Los compuestos fenólicos poseen anillos aromáticos hidrofóbicos y grupos hidroxilo hidrofílicos con la capacidad de enlazar polisacáridos y proteínas. Este tipo de interacciones puede darse por puentes de hidrógeno (entre el grupo hidroxilo de los compuestos fenólicos y los átomos de oxígeno de los enlaces glucosídicos de los polisacáridos), interacciones hidrofóbicas y enlaces covalentes (enlace éster entre ácidos fenólicos y polisacáridos) [21].
Las películas adicionadas con microencapsulado de pulpa de xoconostle presentan una importante capacidad antioxidante. Y al obtener estas características, estas películas pueden ser consideradas como una alternativa en la búsqueda de materiales de embalaje para la industria alimentaria.
[1] de Souza, A. Dias, A., Souza, H., Tadini, C. “Impregnation of cinnamaldehyde into cassava starch biocompositefilms using supercritical fluid technology for the development of foodactive packaging”. Carbohydrate Polymers, 102, 830-837, 2013.
[2] Sornay, P. “Las cucurbitáceas tropicales (Sechium edule Sw.) Chayote-chou chou”. L´Agronomie coloniale. Bulletin Mensuel du Jardín Coloniale. Nouvelle Serie Núm. 37, 1921.
[3] León, J. “Fundamentos Botánicos de los Cultivos Tropicales”. IICA. San José, Costa Rica. 450 p, 1986.
[4]Kechichian, V., Ditchfield, C., Veiga-Santos, P., & Tadini, C. C. “Natural antimicrobial ingredients incorporated in biodegradable films based on cassava starch”. LWT-Food Science and Technology, 43, 1088-1094, 2010.
[5]Reyes-Agüero, J. A., Aguirre, R. J. R., & Valiente-Banuet, A. “Reproductive biology of opuntia: A review”. Journal of Arid Environment, 64, 549–585. 2006.
[6] Morales, P., Ramírez-Moreno, E., Sanchez-Mata, M., Carvalho, A., & Ferreira, I. C. F. R. “Nutritional and antioxidant properties of pulp and seeds of two xoconostle cultivars (Opuntia joconostle F.A.C. Weber ex Diguet and Opuntia matudae Scheinvar) of high consumption in Mexico”. Food Research International, 46, 279–285, 2012.
[7]Guzmán-Maldonado, S. H., Morales-Montelongo, A. L., Mondragón-Jacobo, C., Herrera-Hernández, G., Guevara-Lara, F., Reynoso-Camacho, R. “Physicochemical, nutritional, and functional characterization of fruits xoconostle (opuntia matudae) pears from central-México Region”. Journal of Food Science, vol. 75, C485–C492, 2010.
[8]Morales, E. Tesis: “Evaluación de las propiedades funcionales de pulpa de xoconostle (Opuntia oligacantha) y su conservación mediante microcápsulas”. Universidad Autónoma del Estado de Hidalgo. México. 2012.
[9]Flores-Gorosquera, E., García-Suárez, F. J., Flores-Huicochea, E., Núñez-Santiago, M. C., González-Soto, R. A., & Bello-Pérez, L. A. “Rendimiento del proceso de extracción de almidón a partir de frutos de plátano (Musa paradisiaca), Estudio en planta piloto”. Acta Científica Venezolana, 55, 86–90, 2004.
[10]Aila-Suarez S., Palma-Rodríguez H. M., Rodríguez-Hernández A. I., Hernández-Uribe J. P., Bello-Pérez L. A., Vargas-Torres A., “Characterization of films made with chayote tuber and potato starches blending with cellulose nanoparticles”, Carbohydrate Polymers, 98, p102-107, 2013.
[11]Folinn, C. Ciocalteau, V. “Tyrosine and tryptophan determination in proteins”. J. Biol. Chem. 73, 627-650, 1927.
[12] Waterman, P., Mole, S., “Analysis of phenolic plant metabolites”, Blackwell scientific Publications, Oxford, UK. P.73-74. 1994.
[13]Brand-Williams, W., Cuvelier, M. E. and Berset, C. “Use of a free radical method to evaluate antioxidant activity”. LWT - Food Science and Technology, 28, 25−30. 1995.
[14]Re, R., Pellegrini, N., Pro Teggente, A., Pannala, A., Yang, M., Rice-Evans, C. “Antioxidant activity applying an improved ABTS radical cation decolorization assay”. Free Radical Biology and Medicine, 26, p.1231-1237, 1999.
[15]Pan, Y., Wang, K., Huang, S., Wang, H., Mu, X., He, C. “Antioxidant activity of microwave-assisted extract of longan (Dimocarpus Longan Lour.) peel”. Food Chemistry, 106(3), 1264-1270, 2008.
[16]Wang, L., Dong Y., Men, H., Tong, J., Zhou, J. “Preparation and characterization of active films based on chitosan incorporated tea polyphenols”. Food Hydrocolloids, 32, 35-41. 2008.
[17]Arcan, I., & Yemenicioglu, A. “Incorporating phenolic compounds opens a new perspective to use zein films as flexible bioactive packaging materials”. Food Research International, 44(2), 550-556, 2011.
[18]Moradi, M., Tajik, H., Rohani, S. M. R., Oromiehie, A. R., Malekinejad, H., Aliakbarlu, J. “Characterization of antioxidant chitosan film incorporated with Zataria multiflora Boiss essential oil and grape seed extract”. Food Science and Technology, 46, 477–484, 2012.
[19]Montanheiro Noronha, C., Matos de Carvalho, S., Calegari Lino, R., Manique Barreto, P.L. “Characterization of antioxidant methylcellulose film incorporated with a-tocopherol nanocapsules”. Food Chemistry, 159, 529–535, 2014.
[20]Serrano J., Puupponen Pimiä, R., Dauer, A., Aura, A.M., Saura Calixto, F. “Tannins: Current knowledge of food sources, intake, bioavailability and biological effects”. Molecular Nutrition & Food Research. 53(S2), 310-329, 2009.
[21]Saura-Calixto F. “Dietary Fiber as a Carrier of Dietary Antioxidants: An Essential Physiological Function”. Journal of Agricultural and Food Chemistry. 59(1):43-49, 2010.
[a] Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo.
[b] Departamento de Biotecnología de la Universidad Autónoma Metropolitana-Iztapalapa.