Los estudios in vitro son necesarios para lograr entender los factores que afectan la estabilidad de los compuestos fenólicos durante la digestión. El xoconostle es un fruto que es cultivado en la parte central de México, a éste se le han conferido propiedades antioxidantes, esto debido a la presencia de compuestos bioactivos, tales como los compuestos fenólicos y betalaínas. Pulpa de xoconostle fue obtenida mediante extracción enzimática, la pulpa se mezcló con goma arábiga y maltodextrina para obtener microcápsulas secadas por aspersión. La bioaccesibilidad de compuestos fenólicos fue evaluada en la pulpa natural (PN), mezcla de pulpa con biopolímeros (MPG) y microcápsulas reconstituidas (MR), cada uno de los tratamientos fue mezclado con una solución de pepsina-HCl (fase gástrica), posteriormente se adicionó una solución de pancreatina-sales biliares (fase pancreática), ambas fases, por 2h a 37 °C con agitación. Durante la fase gástrica se observó un aumento en la cantidad de compuestos fenólicos totales para los tres tratamientos con respecto al tiempo inicial. Durante la fase gástrica se observó un incremento en la concentración de compuestos fenólicos, siendo PN estadísticamente superior (p<0.05) a MPG y MR. Durante el proceso final de la simulación gastrointestinal in vitro, fase pancreática, se observó que la concentración alcanzada para MR fue de 74.19±1.45 mg equivalentes de ácido gálico (EAG), mientras que para PN y MPG fue de 61.61±5.13, 54.40±2.3 respectivamente, siendo mayor estadísticamente (p<0.05) la concentración encontrada en MR. Las concentraciones encontradas son mayores a que lo reportado en otros alimentos donde se llevó a cabo una simulación gastrointestinal simulada, como el brócoli, cebolla y manzana. Lo anterior indica que el secado por aspersión protegió a los compuestos fenólicos presentes en el xoconostle durante la simulación gastrointestinal in vitro.
Palabras clave: Xoconostle, bioaccesibilidad, compuestos fenólicos.
In vitro studies are necessary for understand the factors that affect the stability of phenolic compounds during digestion. The xoconostle is a fruit grows in the center of Mexico. It has been conferred antioxidant properties due to the presence of bioactive compounds such as phenolic compounds and betalains. In this study the xoconostle pulp was obtained by enzymatic extraction, the pulp is mixed with Arabic gum and maltodextrin for obtained spray dried microcapsules. The bioavailability of phenolic compounds was evaluated in the natural pulp (PN), pulp mixture with biopolymers (MPG) and reconstituted microcapsules (MR), each of the treatments was mixed with a solution of pepsin-HCl (gastric phase) for 2h at 37 °C , then a solution of pancreatic-bile salts (pancreatic phase) for 2h at 37 °C with stirring. During the gastric phase was observed an increase of the total phenolic compounds in all the treatments in comparison with the initial time. During this phase the concentration of phenolic compounds in PN was statistically superior (p <0.05) than the concentration of phenolic compounds of MPG and MR. In the pancreatic phase was observed that achieved for MR concentration was 74.19 ± 1.45 mg Gallic acid equivalents (EAG), while for PN and MPG was 61.61 ± 5.13, 54.40 ± 2.3 respectively. The concentrations of the phenolic compounds are higher than the reported for other foods like broccoli, onion and apple, this indicate that microencapsulation of the pulp protected the degradation of the phenolic compounds during the gastrointestinal simulation.
Keywords: Xoconostle, bioavailability, phenolic compounds
El fruto de xoconostle (Opuntia joconostle) es un fruto que posee un pericarpio de tonalidad rosa, un mesocarpio de color amarrillo, un endocarpio de color rojo en el que se encuentran incrustadas sus semillas de color café (Osorio-Esquivel et al., 2011). Se le ha dado un uso en la medicina tradicional mexicana como un suplemento para el tratamiento de enfermedades como la diabetes, hipertensión, y obesidad (Osorio-Esquivel et al., 2011). Se ha estudiado que los beneficios anteriormente mencionados se deben a la presencia de varios compuestos como las ácidos fenólicos, betalaínas y flavonoides principalmente, que son compuestos con actividad antioxidante conocida (Scheinvar 1988). El fruto de xoconostle puede tener una doble aplicación, ya que además de lo anteriormente mencionado puede ser una opción para la obtención de colorantes naturales (Fang y Bhandari 2010). La estabilidad de éstos compuestos fenólicos ha sido estudiada en diversas investigaciones, en las que se ha demostrado que pueden ser afectadas por diversos factores como el pH, actividad de agua, exposición a la luz, la presencia de oxígeno, temperatura y actividades enzimáticas (Jiratanan y Rui 2004). La estabilización de las betalaínas y compuestos fenólicos puede mejorase usando tecnologías de microencapsulación, como lo es el secado por aspersión (Pitalua et al., 2010). Éste método se caracteriza por transformar una solución líquida a un polvo, así de esta forma se asegura la biodisponibilidad de los pigmentos (Saenz et al., 2009). Una forma de evaluar la biodisponibilidad y aprovechamiento de los compuestos fenólicos y betalaínas es mediante la realización de ensayos in vivo en los que generalmente se experimenta con animales y humanos, pero esto conlleva a problemas éticos, económicos, además de una variabilidad entre sujetos y esto influye en la interpretación de los datos obtenidos (McClements y Yan 2010). Debido a lo anterior, se han desarrollado metodologías con experimentaciones in vitro para la evaluación de compuestos fenólicos en las que se simulan las condiciones gastrointestinales que ocurren durante el proceso digestivo, en estos estudios se han obtenido una buena correlación con la biodisponibilidad observada in vivo (Gil-Izquierdo et al., 2002). Generalmente a los estudios que se desarrollan de una manera in vitro se les relaciona con el término de bioaccesibilidad, el cual también suele ser definido como la proporción de un nutriente que es liberado de la matriz que lo contiene (Tagliazucchi et al., 2010). En el presente trabajo, se evaluó la bioaccesibilidad de los compuestos bioactivos en polvos de xoconostle (Opuntia joconostle C.F. Först) obtenidos mediante la técnica del secado por aspersión.
El xoconostle (Opuntia joconostle C.F. Först) fue obtenido de Villas de Tezontepec, Hidalgo, México. Para la obtención de la pulpa, los xoconostles se lavaron de forma manual para poder eliminar frutos en mal estado, el picado también se realizó de forma manual. El procesamiento del fruto se hizo en una licuadora industrial (Waring HGBSSSS6, Torrington, Connecticut, USA) durante tres minutos. Posteriormente, se adicionó 0.1 mL de un complejo de enzimas de hemicelulasas y pectinasas (Rohapect B1L, PANIPLUS S.A., Querétaro, México) por cada 200 gr de pulpa, se dejó macerar por tres horas en vasos cubiertos con aluminio para evitar la entrada de luz. Se filtró la pulpa a través de un tamiz del número 100 (0.149 mm) y se realizó un filtrado al vacío para evitar problemas de taponamiento del equipo de secado. Una vez obtenida la pulpa, se mezcló con maltodextrina de maíz con diez equivalentes de dextrosa y goma arábiga (proporción 50:50), ambos biopolímeros fueron obtenidos de Industrias Ragar S.A. de C. V. en la ciudad de México, para alcanzar una concentración de sólidos totales de 30%. Esta mezcla se sometió a la operación de secado por aspersión en un Mini Spray Dryer marca Büchi modelo B-290, con las siguientes condiciones de secado: temperatura de entrada 160 °C, 4 bares de presión y 20 mL min-1 de flujo de entrada.
Se tuvieron los siguientes tratamientos: como testigo, la pulpa natural (PN), mezcla de pulpa con biopolímeros antes del secado (MPG) y las microcápsulas reconstituidas de la pulpa (MR). Para la rehidratación, al polvo obtenido se le adicionó agua destilada con la finalidad de ajustar la humedad que tenía la muestra antes de ser secada (94.1 %).
Para la prueba de bioaccesibilidad se evaluaron los tres tratamientos PN, MPG y MR. El ensayo se realizó de acuerdo a lo publicado por Tagliazucchi et al. 2010 con algunas modificaciones de acuerdo a lo publicado por Pool et al. 2012. Muestras de 10 g fueron transferidas a un matraz volumétrico al cual se le adicionaron 30 mL de fluido gástrico simulado que contenía NaCl a una concentración de 2g/L y pepsina a una concentración de 3.2 g/L, el pH se ajustó a un valor de 2.0 con HCL 2 M. Esta solución fue incubada a 37°C en un baño María con agitación por un tiempo de dos horas. Al inicio y por lapsos de 30 minutos se tomaron alícuotas para los análisis de contenido de fenoles y actividad antioxidante, la reacción se detuvo por la colocación de la muestra en hielo. Las muestras fueron centrifugadas a 17 500g a 5°C por 10 minutos y los sobrenadantes fueron retirados para los análisis correspondientes. Al final de la fase gástrica el valor de pH fue llevado a un valor de 7.5 con bicarbonato de sodio antes de la adición de pancreatina (de origen porcino, Hycel de México) 0.8 g/L y 25 mg/mL de sales biliares (Fluka), la solución fue incubada en las mismas condiciones que el paso anterior. La reacción se detuvo por la colocación de la muestra en hielo. Las muestras que fueron retiradas durante la digestión pancreática fueron inmediatamente acidificadas a un pH 2 para asegurar la estabilidad de los compuestos fenólicos. Los tubos fueron centrifugados bajo las mismas condiciones descritas anteriormente y de la misma forma el sobrenadante se utilizó para realizar los análisis correspondientes. Las muestras que fueron tomadas en cada fase del proceso de bioaccesibilidad y al tiempo inicial, se sometieron a un proceso de extracción con solventes como lo reporta el protocolo de Rojas-Barquera et al. 2008 con una modificación en el volumen de muestra, esto con la finalidad de eliminar la interferencia ocasionada por las gomas en la muestra. La determinación de fenoles totales fue por el método de Folin- Ciocalteau (Reyes-Munguía et al., 2009). Un mililitro de la muestra se colocó en un tubo de ensayo al cual se le adicionó 5 ml de reactivo diluido (1:10) de Folin-Ciocalteau, dejando reposar durante 8 min y posteriormente se adicionaron 4 mL de la solución de carbonato de sodio 7.5% hasta lograr una mezcla homogénea. Los tubos fueron cubiertos para protegerlos de la luz e incubados por 2 h a temperatura ambiente. Posteriormente fueron leídos a 740 nm. Los resultados se expresaron como equivalentes de ácido gálico.
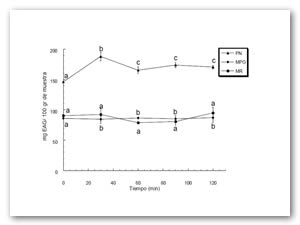
En la Figura 1, se muestran los resultados de fenoles totales expresados en mg de ácido gálico equivalentes por cada 100 g (EAG/100 g) de muestra para los tres tratamientos durante la fase gástrica de la simulación gastrointestinal in vitro. En la PN, después de 30 min, se observó un incremento estadísticamente significativo (p<0.05) en comparación con el tiempo cero en el contenido de fenoles, además de que la concentración se mantuvo constante durante el resto de ésta etapa alcanzando una concentración final de 170.24±2.62 mg EAG/100 g, un comportamiento distinto se obtuvo para MPB ya que no hubo cambios en la concentración de polifenoles, siendo estable la concentración de estos compuestos. En el caso de la evaluación de MR, se observó que la concentración alcanzada al final de esta etapa mostró un aumento significativo (p<0.05) en comparación con el tiempo cero, alcanzándose una concentración final de 95.03±9.62 mg EAG/100 g, la estabilidad de polifenoles presentes en la etapa gástrica ha sido atribuida al bajo valor de pH del medio que se encuentra alrededor de 2-3, en donde varios compuestos fenólicos pueden ser estables durante la digestión gástrica sin tener cambios significativos [12]. El aumento en la concentración de fenoles durante esta etapa puede explicarse al menos en parte, por la liberación de compuestos con actividad antioxidante (principalmente polifenoles) de la matriz alimentaria debido a la acción de las enzimas digestivas, tal como lo demuestra Cilla 2010.
Figura 1: Efecto del tiempo en la concentración de fenoles totales expresados en mg equivalentes de ácido gálico/ 100 gr de xoconostle; durante la fase gástrica en cada tratamiento. PN (pulpa natural), MBG (mezcla biopolímeros y pulpa natural antes del secado y MR (microcápsulas reconstituidas).
Letras idénticas en minúsculas arriba de las barras de error no demuestran diferencia significativa para cada tratamiento con respecto al tiempo (nivel de significancia p<0.05).
Por otra parte durante la fase pancreática se observó una disminución en la concentración de compuestos fenólicos en comparación con la fase gástrica, ya que desde los treinta minutos de iniciada esta etapa la disminución fue evidente para los tres tratamientos, siendo más drástico el descenso de concentración para PN (figura 2). Al final de esta etapa el tratamiento PN alcanzó una concentración del 61.61 mg EAG/ 100 g. Para MPG y MR también se observó una disminución significativa (p<0.05) al minuto treinta con respecto del tiempo cero, pero esta disminución no fue tan drástica en comparación con PN, las concentraciones alcanzadas al final de esta etapa fueron: 54.40±2.31 mg EAG/100 g y 74.19±1.45 mg EAG/100 g para MPG y MR respectivamente. De acuerdo con varias investigaciones, afirman que los compuestos fenólicos que se consumen en la dieta son altamente sensibles a las condiciones medianamente alcalinas que se encuentran en el intestino, por lo que se sugiere que en ésta etapa una porción de estos compuestos debe ser transformado en compuestos de diferente forma estructural que posean diferentes propiedades químicas (Bermúdez-Soto et al., 2007).
Figura 2: Efecto del tiempo en la concentración de fenoles totales expresados en mg equivalentes de ácido gálico/ 100 gr de xoconostle; durante la fase pancreática en cada tratamiento. PN (pulpa natural), MBG (mezcla biopolímeros y pulpa natural antes del secado y MR (microcápsulas reconstituidas). Letras idénticas en minúsculas arriba de las barras de error no demuestran diferencia significativa para cada tratamiento con respecto al tiempo (nivel de significancia p<0.05).
La bioaccesibilidad se puede evaluar mediante el porcentaje de pérdida que se tiene durante todo el proceso, en este aspecto se obtuvo que el porcentaje de pérdida para los tres tratamientos del PN y MPB fueron nulos durante la fase gástrica, ya que se observó un incremento en la concentración de compuestos fenólicos (Tabla 1).
En un estudio realizado a la frambuesa (Aronia melanocarpa) (Bermúdez-Soto et al., 2007), también evaluaron la estabilidad en condiciones de digestión simuladas de polifenoles presentes en mencionado fruto, y reportaron pérdidas por arriba del 50% para la catequina durante la fase gástrica.
Por otra parte el porcentaje de pérdida durante la fase pancreática en los tratamientos fue similar a la que se obtuvieron en un ensayo donde evaluaron la bioaccesibilidad de compuestos fenólicos para el brócoli en donde obtuvieron de un 80-85% de pérdida (Bermúdez-Soto et al., 2007), otro estudio con cebollas y manzanas reportaron hasta un 75% de pérdida (Bermúdez-Soto et al., 2007).
Tomando en cuenta la concentración de compuestos fenólicos y el porcentaje de pérdida al final del ensayo de bioaccesibilidad, se observa que el tratamiento MR obtuvo una concentración significativamente mayor (p<0.05) que PN y un porcentaje de pérdida significativamente menor que PN (p<0.05), lo que sugiere que el encapsulamiento, resulto ser una buena alternativa para la protección de los compuestos fenólicos
Las concentraciones finales que se alcanzaron al final del ensayo de bioaccesibilidad fueron de 61.61±5.13, 54.40±2.31 y 74.19±1.45 mg EAG/100 g para pulpa natural de xoconostle, mezcla de pulpa de xoconostle con gomas y microcápsulas reconstituidas de xoconostle respectivamente, por lo que se concluye que el secado por aspersión, protegió significativamente y ayudo en la bioaccesibilidad de los compuestos fenólicos provenientes del xoconostle.
Bermúdez-Soto M.J., Tómas-Barberán F.A. y García-Conesa M.T. (2007). “Stability of polyphenols in chokeberry (Aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion.” Food Chemistry. Vol. 102. 865-874.
Cilla T.A. (2010). Tesis: “Actividad antioxidante y biodisponibilidad mineral de zumos de frutas adicionados de minerals y/o leche. Universitat de Valéncia, Facultad de Farmacia.
Fang Z., y Bhandari B. (2010). “Encapsulation of polyphenols-a review”, Trends in Food Science & Technology.Vol. 21, p. 510-523
Gil-Izquierdo A., Zafrilla P., Francisco A., y Tomás-Barberán. (2002).”An in vitro method to simulate phenolic compound release from the food matrix in the gastrointestinal tract”, European Food Research and Technology, Vol. 214, p. 155- 159.
Jiratanan T. y Rui H.L. (2004)”Antioxidant activity of processed table beets (Beta vulgaris var. conditiva) and green beans (Phaseolus vulgaris L.)”, Journal of Agricultural and Food Chemistry, Vol. 52, p. 2659-2670.
McClements D.J. y Yan L. (2010). “Review of in vitro digestion models for rapid screening of emulsion-based systems”, Food & Function, Vol.1, p. 32-59.
Osorio-Esquivel O., Ortiz-Moreno A., Álvarez V.B., Dorantes-Álvarez Lidia y Giusti
M. M. (2011). “Phenolics, betacyanins and antioxidant activity in Opuntia joconostle
fruits”. Food Research International. Vol. 44, p. 2160-2168
Pitalua E., Jimenez M., Vernon-Carter E.J. y Beristain C.I. (2010). “Antioxidative activity of microcapsules with beetroot juice using gum Arabic as wall material”, Food and Bioproducts Processing, Vol. 88, p.253-258.
Pool H., Quintanar D., Figueroa J.D., Bechara H.J.E., McClements D.J. y Mendoza S. (2012). “Polymeric nanoparticles as oral delivery systems for encapsulation and release of polyphenolic compounds: Impact on quercetin antioxidant activity & bioaccessibility”. Food Biophysics. Vol 7. No.27,p. 6–288.
Reyes-Munguía A., Azúara-Nieto E., Beristain C.I., Cruz-Sosa F. y Vernon-Carter E.J. (2009). “Purple maguey (Rhoeo discolor) antioxidant properties”, CyTA- Journal of Food, Vol. 7, No. 3, p. 209-216.
Rojas-Barquera D.R., Narváez Cuenca E.C., Restrepo-Sánchez L.P. (2008). “Evaluación del contenido de vitamina C, fenoles totales y actividad antioxidante en pulpa de guayaba (Psidium guajava L.) de las variedades pera, regional roja y regional blanca”. Memorias de Red- Alfa Lagrotech. 49-60.
[12] Saénz C., Tapia S., Chávez J. y Robert P. (2009). “Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)”, Food Chemistry, Vol. 114, p. 616-622.
Scheinvar L. (1988). Los nopales silvestres del estado de Querétaro en sus tipos de vegetación. En: Memoria de la III reunión nacional y I reunión internacional. El nopal. 10-14 de octubre. Saltillo. Coah. México: 39.
Tagliazucchi D., Verzelloni E. y Bertolini D. (2010) “In vitro bio-accessibility and antioxidant activity of grape polyphenols”, Food Chemistry, Vol. 120, p. 599-606.
[a] Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo.
[b] Universidad Autónoma de San Luis Potosí.