Actualmente existe un interés creciente en tecnologías novedosas o no convenciones que permitan desarrollar productos de mejor calidad a un costo menor de proceso. La implementación de tecnologías denominadas “emergentes” ha sido una alternativa para incrementar la eficiencia de procesos alimentarios. Los principales objetivos de estas tecnologías son la reducción del tiempo de procesamiento, el ahorro de energía y la mejora de la calidad y vida de anaquel de los productos alimentarios (Chemat, Zill, & Khan, 2011).
Dentro de las tecnologías emergentes que se han desarrollado en los últimos años destacan el uso de radio frecuencia, calentamiento en microondas, altas presiones hidrostáticas, pulsos eléctricos, campos magnéticos, ozonización y ultrasonido. Aunque estas tecnologías se han aplicado en procesos alimentarios en los países desarrollados, los países en desarrollo deberían beneficiarse del conocimiento ya adquirido en este campo (Ahmed, Ramaswamy, Kasapis, & Boye, 2010). En años recientes, el ultrasonido ha generado expectativas en la industria de alimentos, actualmente se disponen de equipos a nivel industrial y esta tecnología se considera sustentable por su bajo impacto ambiental (Chemat et al., 2011).
El sonido es cualquier fenómeno que involucre la propagación de energía en forma de ondas elásticas (sean audibles o no), generalmente a través de un fluido u otro medio elástico que esté generando el movimiento vibratorio de un cuerpo. Para fines prácticos, el sonido puede clasificarse como (Herrero & Romero de Ávila, 2006):
• Infrasonido (frecuencias < 20 Hz)
• Audible (20 Hz – 20 kHz)
• Ultrasonido (frecuencias > 20 kHz)
Existen dos formas de aplicación del ultrasonido en alimentos: baja y alta intensidad. La primera categoría se caracteriza por frecuencias mayores a 100 kHz con energías inferiores a 1 W/cm2. El ultrasonido de baja intensidad no causa efectos significativos en el material de prueba y en alimentos se usa como herramienta analítica para control de procesos o para obtener información de propiedades fisicoquímicas como la evaluación de burbujas de aire en alimentos aireados, contenido de grasa en productos cárnicos, caracterización de la calidad del huevo, coagulación de la leche, control de la fermentación del vino y caracterización de masas de panificación (Povey, 1989; McClements, 1997; Benedito, Carcel, González, Mulet, 2002; Simal et al., 2003; Resa et al., 2007; Álava et al., 2007). En estas aplicaciones los parámetros a controlar son la medición de la velocidad del ultrasonido, la atenuación de la señal y el análisis de los espectros de frecuencia.
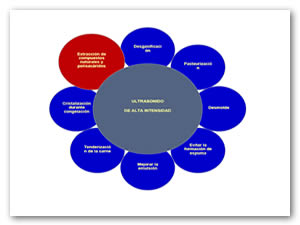
Por otra parte, el ultrasonido de alta intensidad hace uso de frecuencias menores a 100 kHz con energías superiores a 10 W/cm2. Sus aplicaciones generan efectos en el material por la intensa cavitación que se genera (Salazar et al., 2010). Este tipo de ultrasonido ha sido usado con éxito para mejorar algunos procesos o productos alimentarios. Algunas de sus aplicaciones en la industria de alimentos están relacionadas con los procesos de maceración, congelación, extracción de compuestos naturales, modificación de ingredientes, depolimeración de algunos polisacáridos o gomas, procesos de sustitución de azúcar, en fermentaciones, pasteurización de leche, entre otros (Fig. 1). Algunos autores afirman que por medio de las vibraciones mecánicas de alta intensidad, el ultrasonido es capaz de alterar la estructura del alimento y promover ciertas reacciones químicas que pudieran ser utilizadas a favor del proceso. La gama de aplicaciones del ultrasonido de alta intensidad en la industria de los alimentos es amplia y está incrementando rápidamente. Algunos ejemplos incluyen emulsificación, secado, desgasificación, modificación de las propiedades funcionales y la inactivación de microorganismos. El uso de esta tecnología ofrece algunas ventajas valiosas tales como mayor productividad, rendimiento y selectividad, así como un menor tiempo del proceso, una mejor calidad del producto final, reducción de riesgos químicos o físicos al utilizar otras técnicas y es más amigable con el medio ambiente al no generar desechos industriales peligrosos (Chandrapala, Oliver, Kentish, & Ashokkumar, 2012; Chemat et al., 2011; Esclapez, García-Pérez, Mulet, & Cárcel, 2011; Patist & Bates, 2008; Soria & Villamiel, 2010).
Se han reportado varios mecanismos que pueden ser activados por el ultrasonido de alta intensidad o “ultrasonido de potencia”, tales como calentamiento, turbulencia, agitación, fricción, inestabilidad superficial y otros. Aunque no todos están bien estudiados, la mayoría de ellos se puede atribuir a un fenómeno no lineal y muy complejo conocido como “cavitación”. El fenómeno de la cavitación se reportó por primera vez en 1895 por Thornycroft y Barnaby (Salazar et al., 2010), cuando determinaron que el bajo rendimiento de un nuevo torpedo fue la ineficiencia y pérdida de potencia causada por la formación de cavidades en el agua.
Actualmente se reconocen los efectos de ondas de ultrasonido que se propagan en medios líquidos. Estos efectos surgen de procesos físicos que crean, alargan o generan implosión de cavidades gaseosas en un líquido (Suslick, 1989). Las ondas de ultrasonido, como todas las ondas del sonido, consisten de ciclos de expansión y compresión. Durante los ciclos de expansión, una onda de sonido de suficiente intensidad puede generar cavidades en el líquido, para que esto se logre, las presiones negativas asociadas con el ciclo de expansión deben vencer a la tensión interfacial del líquido (Fig. 2). Sin embargo, la tensión interfacial de los líquidos disminuye con la presencia de gas atrapado en ellos o por partículas sólidas suspendidas (Suslick, 1989).
Actualmente se reporta que cuando la potencia del ultrasonido aumenta, se presentan cambios químicos y físicos en el medio líquido por la generación y posterior destrucción de burbujas de cavitación. Cuando un líquido se somete a ultrasonido con suficiente potencia, el líquido se comprime y se expande, formando pequeñas burbujas o cavidades (Fig. 2). Estas burbujas crecen y se encogen con los ciclos de expansión y compresión de la onda ultrasónica, cuando alcanzan un tamaño crítico éstas explotan. El colapso de estas burbujas puede ser tan violento, que puede causar daños considerables al medio circundante. Suslick (1989) reportó que los vapores y gases dentro de las cavidades se comprimen, generando calor intenso que da lugar a un incremento importante de la temperatura del líquido que rodea a la cavidad, lo cual genera “puntos calientes” en el líquido. Suslick estimó temperaturas cercanas a 5500 °C dentro de la cavidad y alrededor de 2100 °C en el líquido que rodea la cavidad; mientras que la presión máxima estimada fue de 500 atmósferas (Suslick, 1989), lo cual ocurre en tiempos menores a un microsegundo. Este calentamiento o “puntos calientes” pueden conducir a reacciones químicas en la interfase líquido-gas o sólido-gas, si el líquido donde se propaga el ultrasonido contiene partículas sólidas. Cabe señalar que este calor es transitorio y se da a pequeña escala, por lo que se disipa rápidamente y el aumento global de temperatura en el medio líquido es relativamente bajo (Suslick, 1989).
Figura 2 Fenómeno de cavitación durante el ultrasonido de alta intensidad (adaptado de Salazar et al., 2010).
La cavitación genera también radicales libres debido a la disociación del vapor atrapado en las burbujas de cavitación, lo cual intensifica reacciones químicas o altera mecanismos de reacción. Otro efecto de la cavitación es la formación de turbulencia local y micro-circulación del líquido en el reactor o recipiente contenedor, lo cual favorece los mecanismos de transporte, principalmente disminuye la resistencia a la transferencia de masa en sistemas heterogéneos (Gogate & Kabadi, 2009).
En alimentos, la extracción de compuestos naturales es de interés principalmente por las propiedades funcionales o nutracéuticas de estos extractos. Los procesos de extracción se han centrado principalmente en compuestos vegetales. Las plantas contienen una amplia gama de compuestos bioactivos tales como lípidos, fitoquímicos, sabores, fragancias, pigmentos, polisacáridos, etc., que son ampliamente utilizados en las industrias de alimentos, farmacéutica y cosmética. El interés en estos compuestos ha llevado a una creciente necesidad de mejores métodos de extracción para incrementar el rendimiento de extracción de componentes bioactivos en menores tiempos de procesamiento y costos. Existen diversas técnicas de extracción, como la maceración, digestión, infusión, decocción, filtración, extracción continua a temperatura elevada, extracción con fluidos supercríticos, asistida con microondas y extracción asistida con ultrasonido. Las principales diferencias entre estas técnicas están relacionadas con el diseño de los reactores, los disolventes utilizados, el tiempo y la temperatura de los procesos, o el uso de tecnologías no convencionales (i.e. microondas, ultrasonido, fluidos supercríticos, pulsos eléctricos, entre otras).
Los métodos convencionales de extracción líquido-sólido son laboriosos, consumen mucho tiempo y con frecuencia requieren grandes volúmenes de disolventes orgánicos. Sin embargo, hoy en día, la tendencia es utilizar disolventes menos contaminantes. Una de las técnicas de extracción no convencional es la extracción asistida por ultrasonido (USAE, por sus siglas en inglés), es un proceso que ha adquirido interés particular por la comunidad científica mundial. Esta tecnología ha resultado de interés para obtener antioxidantes de fuentes vegetales, proteínas, azúcar, almidones, aceites, sabores y fragancias (hierbabuena, lavanda, vainilla, etc.). Entre las ventajas de esta tecnología de extracción se puede mencionar el mejoramiento en la eficiencia de la extracción, son procesos más rápidos, se puede reducir la temperatura del proceso y se favorece la disolución de los compuestos de interés. Si el proceso se lleva a cabo a temperaturas altas (ejemplo en la extracción de compuestos no volátiles y/o no termolábiles), se mejora la solubilidad de los analitos en el disolvente y se facilita su difusión desde la matriz de la muestra al medio líquido exterior. Por otro lado, el aumento de la presión local (debida al choque de las ondas ultrasónicas) facilita tanto la penetración del disolvente en la matriz de la muestra como el proceso de transporte de los compuestos de interés. Además, la implosión de las burbujas de cavitación puede golpear la superficie de la matriz sólida y desintegrar células vegetales en procesos de extracción de productos naturales, como consecuencia de estos efectos, la extracción se realiza en menos tiempo que en los procesos de extracción convencionales (Veillet, Tomao, & Chemat, 2010). Los polisacáridos de origen vegetal son compuestos de alto valor agregado debido a sus propiedades funcionales, dentro de los cuales destacan pectinas, polisacáridos bioactivos y compuestos celulósicos. En la Cuadro 1 se presentan los trabajos más representativos de extracción de polisacáridos con asistencia de ultrasonido.
En particular, la extracción de pectinas o polisacáridos pécticos resulta de interés por las propiedades reológicas que imparten estos hidrocoloides a los medios en donde son incluidos y por su bioactividad. Actualmente, las pectinas son polisacáridos que se usan para incrementar la viscosidad de alimentos, para estabilizar suspensiones, como agentes gelificantes y como materiales para elaborar películas comestibles para empacar alimentos. Adicionalmente, las pectinas han ganado interés como compuestos bioactivos en productos farmacéuticos o de cuidado personal. Diversos estudios han comprobado que los polisacáridos pécticos o sus derivados ejercen diversos efectos benéficos para la salud, entre otros: bloquean la adherencia de varios microorganismos patógenos en la mucosa intestinal, lo cual es un paso importante en la patogénesis de infecciones gastrointestinales, disminuyen los niveles de colesterol en sangre, reducen la absorción de glucosa en suero de pacientes diabéticos y/u obesos, muestran efectos inmuno-regulatorios en el intestino, además de la función como fibra dietética (Voragen, Coenen, Verhoef, & Schols, 2009). Hasta ahora, la industria de pectinas hace uso de métodos de extracción tradicionales que generan efluentes muy contaminantes (pH ≈ 1) y se ha enfocado principalmente a la obtención de pectinas cítricas y de manzana. No obstante, es posible obtener polisacáridos pécticos, tanto de fuentes convencionales como no convencionales, a través del uso de ondas de ultrasonido para facilitar su extracción, lo cual puede ser atractivo desde el punto de vista económico y científico.
Cuadro 1. Estudios del ultrasonido de alta intensidad en extracción de polisacáridos
Material a extraer |
Potencia |
Generador de ultrasonido |
Frecuencia (kHz) |
Tiempo |
Relación H2O/ extracto mL/g |
Temperatura (°C) |
Rendimiento óptimo (método convencional) | Rendimiento óptimo (ultrasonido) | Condiciones óptimas (ultrasonido) |
Referencias |
| Producción de pectinas de bajo grado de esterificación | I≈1.2-1 W/cm2 |
Sonda ultrasónica |
22 |
30 y 60 min |
NR |
40, 50 y 60 |
9.0% |
10.8% |
30 min y una temperatura de 40-60 °C. |
(Panchev, Kirtchev, & Kratchanov, 1994) |
Polisacáridos medicinales de raíz de Valeriana |
600 W I= 1 W/cm2 |
Desintegrador ultrasónico con bocina 79 cm de largo y 5cm de diámetro. | 20 |
2 h |
NR |
NR |
11.9% |
11.5% |
Sólo se usó una condición. |
(Hromádková, Ebringerová, & Valachovic, 2002) |
| Hemicelulosa de cáscara de trigo | 100 W I≈8W/cm2 |
Sonda ultrasónica | 20 | 5 y 10 min | NR | 40 y 60 | 8.3-11.2% en 60 min |
16.5% | 60 °C y 10 min. | ( Hromádková & Ebringerová, 2003) |
| Xiloglucanos de pomaza de manzana | 160 W |
Baño ultrasónico |
59 |
0.25, 0.5, 1, 2, 3, 4 y 5 h. |
25:1, 30:1, 35:1, 40:1 y 45:1 |
NR |
NR |
3 veces más rápido que la convencional | 34.4 relación H2O/extracto, 2.5 h y 3.3 M KOH. |
(Caili, Haijun, Quanhong, Tongyi, & Wenjuan, 2006) |
Heteroxilanos de salvado de trigo |
100 W I≈8 W/cm2 |
Sonda ultrasónica (20 mm diámetro y 120 mm largo) |
20 |
5 y 10 min |
10:1 (0.5, 2 y 5% NaOH) |
40 y 60 |
NR |
NR |
El uso de ultrasonido disminuyó el uso de NaOH y se obtuvieron rendimientos mayores usando ultrasonido durante tiempos menores a 10 min. | (Hromadkova, Kost'alova, & Ebringerova, 2008) |
| Polisacáridos pécticos de semilla de calabaza | 100 W I≈8 W/cm2 |
Sonda ultrasónica |
NR |
5 y 10 min |
52:1 y 70:1 |
35 |
22.4% en 60 min. |
22.9% |
5 min, relación 70:1 mL/g. | (Košt´álová, Hromádková, & Ebringerová, 2010) |
| Pectinas de toronja | 200 W |
Sonda ultrasónica |
24 |
4, 12, 15, 20 y 30 min |
NR |
50, 60, 70 y 80 |
19.16% en 90 min. |
17.92% |
25 min, 70 °C. |
(Bagherian, Zokaee Ashtiani, Fouladitajar, & Mohtashamy, 2011). |
| Polisacáridos medicinales de semillas de Litchi | 120, 210 y 300 W |
NR |
NR |
5, 25 y 45 min |
5:1, 10:1 y 15:1 |
NR |
NR |
NR |
222 W, 45 min y 15:1 relación solvente/extracto. |
(Chen, Luo, Gao, & Zhu, 2011) |
| Polisacáridos antioxidantes de hongos blancos, Agaricus bisporus | 160-320 W |
Limpiador ultrasónico (KQ-400KDV) | 25 |
20-100 min. |
20:1, 25:1, 30:1, 35:1 y 40:1. |
60, 65, 70, 75 y 80 |
2.36% |
5.88% |
230 W, 70 ºC, 64.4 min y 30:1. |
(Tian et al., 2012) |
| Inulina | 20-100 % AU | Sonda ultrasónica | 25 | 5-25 min | NR | 20-60 | NR | NR | 83.22 % AU, 25 min y 36.76 ºC |
(Milani, Koocheki, & Golimovahhed, 2011) |
| β-glucanos de cebada | 400 W |
Sonda ultrasónica |
24 |
3, 10 y 17 min. |
10:1 |
55 |
NR |
66.1% |
El uso de ultrasonido mejora el tiempo de proceso y usa menor cantidad de energía. | (Benito-Román, Alonso, & Cocero, 2013) |
| Polisacáridos de hongos medicinales | 130 y 900 W | 2 diferentes generadores de sonda ultrasónica | 20 |
10, 20, 40, 55, 70 y 80 min. |
30:1, 50:1 y 70:1. |
40, 55 y 70. |
8.5% |
18% |
80 min, 44.1 W/cm2, 70 ºC y 1:30. |
(Cheung & Wu, 2013) |
| Polisacáridos de calabaza (Cucurbita moschata) | 50-70 W |
Generador ultrasónico | 20 |
10, 15, 20, 25 y 30 min. |
5:1, 10:1, 15:1, 20:1 y 25:1. |
40, 50, 60 y 70. |
NR |
16.04% |
70 W, 23 min y 1:10. |
(Prakash Maran, Mekala, & Manikandan, 2013) |
Polisacáridos medicinales del cabello de elote |
250 W |
Limpiador ultrasónico |
40 |
10 - 30 min. |
10:1 – 30:1. |
40 - 60. |
NR |
6.06% |
56 ºC, 17 min y 1:20. |
(Prakash Maran, Manikandan, Thirugnanasambandham, Vigna Nivetha, & Dinesh, 2013) |
| Arabinoxilanos de salvado de trigo | 100-300 W | Tanque ultrasónico | NR | 40 – 100 min. |
30 - 60 g/L | 40 – 60. | NR | 14.26% | 50 ºC, 70 min, 180 W y 50 g/L. |
(Wang, Sun, Liu, & Zhang, 2014) |
Pectina de toronja |
30-80 W |
Sonda ultrasónica | 20 |
10, 20, 30, 40, 50 y 60 min. |
30:1, 46:1, 50:1, 60:1 y 70:1. |
30, 40, 50, 60, 70 y 80. |
23.44% |
26.74% |
70 W, 60 ºC, 52 min y 50:1. |
(Xu, 2014) |
NR=no reportado, AU=amplitud ultrasónica.
Ahmed, J., Ramaswamy, H. S., Kasapis, S., Boye, J. I. (2010). Introduction en “Novel Food Processing: Effects on Rheological and Functional Properties”. Jasim Ahmed, Hosahalli S. Ramaswamy, Stefan Kasapis & Joyce I. Boye (Eds). CRC Press, Taylor & Francis Group. Boca Raton Florida, Estados Unidos de América. Pag: 1-6.
Álava, J. M., Sahi, S. S., García-Álvarez, J., Turó, A., Chávez, J. A., García, M. J.,
Salazar, J. (2007). Use of ultrasound for the determination of flour quality. Ultrasonics, 46, 270–76.
Bagherian, H., Zokaee Ashtiani, F., Fouladitajar, A., & Mohtashamy, M. (2011). Comparisons between conventional, microwave- and ultrasound-assisted methods for extraction of pectin from grapefruit. Chemical Engineering and Processing: Process Intensification, 50(11-12), 1237-1243. doi: 10.1016/j.cep.2011.08.002
Benedito, J., Carcel, J. A., González, R., Mulet, A. (2002). Application of low intensity ultrasonics to cheese manufacturing processes. Ultrasonics, 40, 19–23.
Benito-Román, Ó., Alonso, E., & Cocero, M. J. (2013). Ultrasound-assisted extraction of β-glucans from barley. LWT - Food Science and Technology, 50(1), 57-63. doi: 10.1016/j.lwt.2012.07.006
Caili, F., Haijun, T., Quanhong, L., Tongyi, C., Wenjuan, D. (2006). Ultrasound-assisted extraction of xyloglucan from apple pomace. Ultrasonics Sonochemistry, 13, 511-516.
Chandrapala, J., Oliver, C., Kentish, S., & Ashokkumar, M. (2012). Ultrasonics in food processing. [Review]. Ultrason Sonochem, 19(5), 975-983. doi: 10.1016/j.ultsonch.2012.01.010
Chemat, F., Zill e, H., & Khan, M. K. (2011). Applications of ultrasound in food technology: Processing, preservation and extraction. [Review]. Ultrason Sonochem, 18(4), 813-835. doi: 10.1016/j.ultsonch.2010.11.023
Chen, Y., Luo, H., Gao, A., & Zhu, M. (2011). Ultrasound-assisted extraction of polysaccharides from litchi (Litchi chinensis Sonn.) seed by response surface methodology and their structural characteristics. Innovative Food Science & Emerging Technologies, 12(3), 305- 309. doi: 10.1016/j.ifset.2011.03.003
Cheung, Y.-C., & Wu, J.-Y. (2013). Kinetic models and process parameters for ultrasound-assisted extraction of water-soluble components and polysaccharides from a medicinal fungus. Biochemical Engineering Journal, 79, 214-220. doi: 10.1016/j.bej.2013.08.009
Esclapez, M. D., García-Pérez, J. V., Mulet, A., & Cárcel, J. A. (2011). Ultrasound-Assisted Extraction of Natural Products. Food Engineering Reviews, 3(2), 108-120. doi: 10.1007/s12393-011- 9036-6
Gogate, P. R., & Kabadi, A.M. (2009). A review of applications of cavitation in biochemical engineering /biotechnology. Biochemical Engineering Journal, 44(1), 60-72.
Herrero, M.A., Romero de Ávila, M.D. (2006). Innovaciones en el procesado de alimentos: Tecnologías no térmicas. Rev. Med. Univ. Navarra, Vol. 50, 71-74.
Hromádková, Z., & Ebringerová, A. (2003). Ultrasonic extraction of plant materials––investigation of hemicellulose release from buckwheat hulls. Ultrason Sonochem, 10(3), 127-133. doi: 10.1016/s1350-4177(03)00094-4
Hromádková, Z., Ebringerová, A., & Valachovic, P. (2002). Ultrasound-assisted extraction of water- soluble polysaccharides from the roots of valerian (Valeriana officinalis L.). Ultrasonics Sonochemistry, 9, 37-44.
Hromadkova, Z., Kost'alova, Z., & Ebringerova, A. (2008). Comparison of conventional and ultrasound-assisted extraction of phenolics-rich heteroxylans from wheat bran. [Research Support, Non-U.S. Gov't]. Ultrason Sonochem, 15(6), 1062-1068. doi: 10.1016/j.ultsonch.2008.04.008
Košt´álová, Z., Hromádková, Z., & Ebringerová, A. (2010). Isolation and characterization of pectic polysaccharides from the seeded fruit of oil pumpkin (Cucurbita pepo L. var. Styriaca). Industrial Crops and Products, 31(2), 370-377. doi: 10.1016/j.indcrop.2009.12.007
McClements, D. J. (1997). Ultrasonic characterization of foods and drinks: Principles, methods, and applications. Critical Reviews in Food Science and Nutrition, 37, 1–46.
Milani, E., Koocheki, A., & Golimovahhed, Q. A. (2011). Extraction of inulin from Burdock root (Arctium lappa) using high intensity ultrasound. International Journal of Food Science & Technology, 46(8), 1699-1704. doi: 10.1111/j.1365-2621.2011.02673.x
Panchev, I. N., Kirtchev, N.A., & Kratchanov, C.G. (1994). On the production of low esterified pectic raw materials with ultrasound treatment. Food Hydrocolloids, 8(1), 9-17.
Patist, A., & Bates, D. (2008). Ultrasonic innovations in the food industry: From the laboratory to commercial production. Innovative Food Science & Emerging Technologies, 9(2), 147-154. doi: 10.1016/j.ifset.2007.07.004
Povey, M. J. W. (1989). Ultrasonics in Food Engineering. Part II: Applications. Journal of Food Engineering, 9, 1-20.
Prakash Maran, J., Manikandan, S., Thirugnanasambandham, K., Vigna Nivetha, C., & Dinesh, R. (2013). Box-Behnken design based statistical modeling for ultrasound-assisted extraction of corn silk polysaccharide. Carbohydr Polym, 92(1), 604-611. doi: 10.1016/j.carbpol.2012.09.020
Prakash Maran, J., Mekala, V., & Manikandan, S. (2013). Modeling and optimization of ultrasound- assisted extraction of polysaccharide from Cucurbita moschata. Carbohydr Polym, 92(2), 2018-2026. doi: 10.1016/j.carbpol.2012.11.086
Resa, P., Bolumar, T., Elvira, L., Pérez, G., Montero de Espinosa, F. (2007). Monitoring lactic acid fermentation in culture broth using ultrasonic velocity. Journal of Food Engineering, 78, 1083–91.
Salazar, J., Chávez, J. A., Turó, A. García-Hernández, M. J. (2010). Effect of Ultrasound on Food Processing. En “Novel Food Processing: Effects on Rheological and Functional Properties”. Jasim Ahmed, Hosahalli S. Ramaswamy, Stefan Kasapis & Joyce I. Boye (Eds). CRC Press, Taylor & Francis Group. Boca Raton Florida, Estados Unidos de América. Pag: 65-84.
Simal, S., Benedito, J., Clemente, G., Femenia, A., Rosselló, C. (2003). Ultrasonic determination of the composition of a meat-based product. Journal of Food Engineering, 58, 253–57.
Soria, A. C., & Villamiel, M. (2010). Effect of ultrasound on the technological properties and bioactivity of food: a review. Trends in Food Science & Technology, 21(7), 323-331. doi: 10.1016/j.tifs.2010.04.003
Suslick, K. S. (1989). The Chemical Effects of Ultrasound. Scientific American, 2, 80-86.
Tian, Y., Zeng, H., Xu, Z., Zheng, B., Lin, Y., Gan, C., & Lo, Y. M. (2012). Ultrasonic-assisted extraction and antioxidant activity of polysaccharides recovered from white button mushroom (Agaricus bisporus). Carbohydrate Polymers, 88(2), 522-529. doi: 10.1016/j.carbpol.2011.12.042
Veillet, S., Tomao, V., & Chemat, F. (2010). Ultrasound assisted maceration: An original procedure for direct aromatisation of olive oil with basil. Food Chemistry, 123(3), 905-911.
Voragen, A. G. J., Coenen, G. J., Verhoef, R. P., & Schols, H. A. (2009). Pectin, a versatile polysaccharide present in plant cell walls. Structural Chemistry, 20(2), 263-275. doi: 10.1007/s11224-009-9442-z
Wang, J., Sun, B., Liu, Y., & Zhang, H. (2014). Optimisation of ultrasound-assisted enzymatic extraction of arabinoxylan from wheat bran. Food Chemistry, 150, 482-488. doi: 10.1016/j.foodchem.2013.10.121
Xu, Y., Zhang, l., Bailina, Y., Ge, Z., Ding, T., Ye, X., & Liu, D. (2014). Effects of ultrasound and/or heating on the extraction of pectin from grapefruit peel. Journal of Food Engineering, 126, 72-81.
[a] Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo.