Proteins and genetic code
Palabras clave: Proteínas, código genético, ARN, enfermedades neurodegenerativas.
Keywords: Proteins, genetic code, RNA, neurodegenerative diseases.
La mayoría de nosotros asocia a las proteínas con el hábito de una buena alimentación o bien, con su relación con el ejercicio para adquirir musculatura. Sin embargo, las tareas que llevan a cabo las proteínas son mucho más diversas y complejas. Incluso, alteraciones en el proceso de la formación de las proteínas pueden provocar consecuencias muy graves en nuestro cuerpo. Esto último ha despertado el interés de muchos científicos por estudiar las posibles causas de las alteraciones de las proteínas, propiciando la interacción de investigadores de áreas muy diversas como son química, biología, física, matemática y medicina.
Pero, ¿Qué son y para qué sirven las proteínas? Te invitamos a leer este artículo para que conozcas más sobre estas biomoléculas y sus funciones.
El código genético es un conjunto de normas por las que la información codificada en el material genético (secuencias de ácido desoxirribonucleico -ADN - o ácido ribonucleico -ARN) se traduce en proteínas en las células vivas [7] [12] [8]. Las proteínas son macromoléculas que consisten de cadenas lineales formadas por bloques fundamentales llamados aminoácidos. Asombrosamente solo hay 20 tipos diferentes de aminoácidos, los cuales, dependiendo del número y del orden en el cual se conecten entre sí, permitirán crear una gran variedad de proteínas, cada una de ellas con una función específica. Por lo que podríamos decir que los aminoácidos son los “ladrillos” (estructuras fundamentales) de las proteínas.
Dentro de esa gran variedad de funciones que realizan las proteínas tenemos algunas que son hormonas, las cuales regulan las actividades celulares y de los tejidos. Otras proteínas tienen una función de transporte, como la hemoglobina que transporta oxígeno y dióxido de carbono en los glóbulos rojos de la sangre. Otras desempeñan un papel fundamental en el sistema inmune de cualquier ser vivo, por ejemplo, las inmunoglobulinas que defienden al organismo contra las infecciones bacterianas y virales. Otras más, las proteínas de los ribosomas, son necesarias para el proceso de la traducción (proceso que convierte una secuencia de ARN mensajero –ARNm- en una cadena de aminoácidos para formar una proteína), en tanto que otras desempeñan algún papel en la regulación de la expresión de los genes.
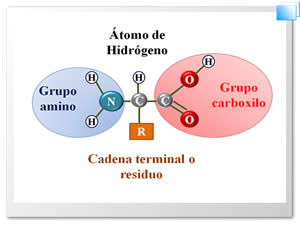
Más allá de la definición propiamente química que se pueda dar de un aminoácido, podemos decir que es una molécula orgánica que consta de un átomo de carbono, unido a un átomo de hidrógeno, a un grupo carboxilo, a un grupo amino y a un grupo que varía según el aminoácido del que se trate, llamado residuo (R) (Ver Figura 1).
Figura 1. La estructura química de un aminoácido.
Las propiedades químicas de los aminoácidos son un reflejo de las diferencias entre sus grupos R. Por ejemplo, de acuerdo a las interacciones de los residuos R con el agua, los aminoácidos se pueden clasificar en hidrofóbicos e hidrofílicos, los primeros generalmente se encuentran en el interior de la estructura de las proteínas de manera que no tienen contacto directo con el agua y los segundos son los que tienden a interactuar con medios acuosos.
Por su complejidad, una proteína se puede describir de acuerdo a cuatro jerarquías conformacionales llamadas estructuras. La estructura primaria es la secuencia en la cual los aminoácidos están conectados mediante un tipo de enlace llamado peptídico (Ver figura 2), resultando una cadena a la que se le llama cadena polimérica o péptido.
Figura 2. Enlace peptídico.
Los otros niveles, que describen la estructura tridimensional de una proteína, incluyen la estructura secundaria, que se refiere a la forma local que adoptan las proteínas, distinguiéndose esencialmente dos estructuras: La hélice α y la hoja β. La estructura terciaria es propiamente la estructura tridimensional y la biológicamente más activa, ésta contiene varios péptidos, conocida como polipéptido complejo. En algunas proteínas, existe la estructura cuaternaria, que es la organización de dos o más cadenas de polipéptidos que en conjunto forman una proteína con muchas subunidades (Ver. Figura 3). Al procedimiento mediante el cual una proteína alcanza su estructura tridimensional se le llama plegamiento.
Figura 3. Estructuras de las proteínas [9].
La actividad biológica de una proteína depende de su conformación general o de la forma que adopte después de su plegamiento. En condiciones fisiológicas normales, la proteína asume una forma única, estable, que se conoce como conformación nativa.
Sin embargo, en ocasiones estos procesos sufren alteraciones que se relacionan con muchas enfermedades cotidianas.
El mal plegamiento de las proteínas está asociado con enfermedades neurodegenerativas, devastadoras e irreversibles, tales como la enfermedad de Alzheimer, el mal de Parkinson, la enfermedad de Creutzfeldt-Jacob en humanos [11] –comúnmente conocida como el mal de las vacas locas en los animales-; e incluso aún, el virus que causa el SIDA [10]. Analizar las posibles causas que provocan alteraciones en el plegamiento de las proteínas es de suma importancia desde el punto de vista médico, social y familiar, ya que las enfermedades neurodegenerativas reducen la calidad y tiempo de vida de los pacientes. Investigaciones recientes muestran que la presencia de algunos metales como el cobre, el fierro y el magnesio (la mayoría divalentes) inducen un mal plegamiento en las proteínas asociadas con el desarrollo de la enfermedad de Alzheimer [1] [2] [6] y el mal de Parkinson [4]. En el Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, y también en el Centro de Ciencias de la Complejidad de la UNAM, varios grupos de investigadores de diversas disciplinas se encuentran analizando precisamente esta posible relación entre los metales y las enfermedades neurodegenerativas [4], cada uno de ellos con un enfoque propio. Así mismo las herramientas empleadas son muy variadas, entre ellas se encuentran los modelos físicos y las simulaciones computacionales en la investigación de las relaciones de incrementos anormales en la concentración de magnesio con la enfermedad de Alzheimer, las cuales pueden ser corroboradas con experimentos in vivo. Otra enfermedad relacionada con el mal plegamiento de las proteínas es la diabetes mellitus (DM), ya que en la DM los niveles de glucosa sanguíneos aumentan, provocando alteraciones en 3 macromoléculas fundamentales del metabolismo: carbohidratos, lípidos y proteínas [3] [5].
En resumen, comprender los procesos que alteran la síntesis y la correcta formación de las proteínas nos permitirá entender y analizar de una mejor manera el surgimiento de algunas enfermedades que son comunes en la población mexicana, y posiblemente podamos encontrar formas de prevenir dichas enfermedades. Es así como el estudio del mal plegamiento de las proteínas y sus consecuencias en las enfermedades neurodegenerativas, nos pone de frente a un tema muy complejo, con múltiples retos, pero a la vez fascinante y que exige la interacción y la urgente colaboración de múltiples disciplinas de las ciencias básicas y de la salud, así como de otras especialidades.
[1]Andrási, E., Páli, N., Molnár, Z. & Kösel, S. 2005. Brain aluminum, magnesium and phosphorous contents of control and Alzheimer-diseased patients. Journal of Alzheimer’s Disease, vol. 7, number 4/2005, 273—284.
[2]Amadoruge, P. C. & Barnham, K. J. 2011. Alzheimer’s disease and metals: a review of the involvement of cellular membrane receptors in metallosignalling. International Journal of Alzhemier’s Disease, vol. 2011 Article ID 542043, 9 pages, doi:10.4061/2011/542043.
[3]Assert, R., Scherk, G., Bumbure, A., Pirag, V., Schatz, H. & Pfeiffer, A. F. 2001. Regulation of protein kinase C by short term hyperglycaemia in human platelets in vivo and in vitro. Diabetologia 2001-02, 44(2), 188-95.
[4]Binolfi A., Rodríguez, E. E., Valensin, D’Amelio, N., Ippoloti, E., Obal, G., Durán, R., Magistrato, A., Pritschy, O., Zwecksletter, M., Valensin, G., Carloni, P., Quintanar, L., Griesinger, C. & Fernández, C. 2010. Bioinorganic Chemistry of Parkinson’s Disease: Structural Determinants for the Copper-Mediated Amyloid Formation of Alpha-Synuclein. Inorganic Chermistry, 49, 10668-10679.
[5]Cuanedo Almagro, P. 2005. Alteraciones de la hemostasia en la diabetes mellitus. Rev Cubana Hematol Inmunol Hemoter. Instituto de Hematología e Inmunología, 21(1) 10 pág.
[6]Honda, K., Smith, M. A., Zhu, X., Bauss, D., Merrick, W. C., Tartakoff, A. M., Hattier, T., Harris, P. L., Siedlak, S. L., Fujioka, H., Liu, Q., Moreira, P. I., Miller, F. P. & Nunomura, A., Shimohama, S. 2005. Ribosomal RNA in Alzheimer disease is oxidized by bound redox-active iron. The Journal of Biological Chemistry, The American Society of Biochemistry and Molecular Biology, Inc., vol. 280, No. 22, Issue of June 2, 20986—20986.
[7]Horton, H. R., Moran, L. A., Ochs, R. S., Rawn, J. D., Scrimgeour, K. G. 1995 Bioquímica (Edición en español). México: Prentice-Hall Hispanoamericana, S. A.
[8]http://es.wikipedia.org/wiki/Código_genético
[9]Imagen basada en http://commons.wikimedia.org/wiki/File:Estructura_prote%C3%ADnas.png
[10]Li, P. T. and Tinoco I. Jr. 2009. Mechanical unfolding of two DIS RNA kissing complexes from HIV-1. J. Mol. Biol. 386(5): 1343-1356.
[11]Navarrete, E., Próspero, O., Hudson, R. y Guevara, R. (2000). Enfermedades neurodegenerativas que cursan con demencia. Gac. Méd. Méx. 136(6): 189-200.
[12]Nelson, D. L., Cox, M. M. (Abril 16, 2004). Principles of Biochemistry (4th. ed.). USA: Freeman, W. H. & Company.
[a1]Miembro del Área Académica de Matemáticas y Física. Doctorado en el Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, México. Áreas de interés: biofísica, simulación computacional, y física estadística.
[a2]Miembro del Área Académica de Matemáticas y Física de la Universidad Autónoma del Estado de Hidalgo. Candidata a Doctora en el Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, México. Áreas de interés: biomatemáticas, y neurociencias.
[a3]Miembro del Área Académica de Matemáticas y Física de la Universidad Autónoma del Estado de Hidalgo. Maestría en Universidad de Virginia, EEUU. Áreas de interés: biomatemáticas y procesos estocásticos.
[a4]Miembro del Área Académica de Matemáticas y Física de la Universidad Autónoma del Estado de Hidalgo. Doctorado en el Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, México. Áreas de interés: física teórica y procesos estocásticos.