
Acid-base chemistry of non aqueous solvents: glacial acetic acid
La química en solventes no acuosos en muchas ocasiones ayuda al análisis cualitativo y cuantitativo de especies químicas que simplemente no son accesibles en medio acuoso. Hasta hoy, el conocimiento empírico ha establecido ciertas normas generales a seguir en cuanto a la aplicación de estos solventes en la industria y se cuenta con poco conocimiento científico acerca de los procesos fisicoquímicos que se establecen en este tipo de medios. En el presente trabajo se describen los principios de la química ácido-base cuando el solvente usado es ácido acético glacial. Siendo este solvente una especie ácida, es capaz de nivelar bases de forma que presentan un comportamiento fuerte mientras que en agua resultarían muy débiles para su análisis. Al ser un solvente de baja polaridad, los solutos presentarían un proceso químico de formación de pares iónicos que antecede a la ionización, siendo este último proceso poco favorecido. Considerando todo lo anterior, la interpretación fisicoquímica para la reacción de bases con un ácido (como el perclórico), disueltos en ácido acético glacial, tiene una orientación muy diferente a la que se usa comúnmente en medio acuoso.
Palabras clave: Solventes no acuosos, ácido acético glacial, química ácido-base.
Chemistry in non-aqueous solvents often helps the qualitative and quantitative analysis of chemical species which are simply not accessible in aqueous media. To date, empirical knowledge has established some general rules regarding the application of these solvents in the industry, while there is poor scientific knowledge about the physicochemical processes related with this type of media. In this paper we describe the principles of acid-base chemistry when glacial acetic acid is used as solvent. Since this is an acidic solvent, it is capable of leveling bases so they would present a strong behavior while in water the same bases would be too weak for analysis. Being a low polarity solvent, solutes present an ion-pair formation process which precedes the ionization, which is less favored. Considering the above, the physicochemical interpretation for base reactions with acids (such as perchloric), both dissolved in glacial acetic acid, has very different scope that the one commonly used in aqueous media.
Key words: Non aqueous solvents, glacial acetic acid, acid-base chemistry.
El uso del ácido acético glacial como solvente se remonta hasta el año de 1884 cuando Raoult realizaba mediciones crioscópicas en soluciones de compuestos orgánicos, y desde entonces se ha diversificado el estudio del comportamiento de especies en este medio para estudiar características que en otros solventes serían difíciles de apreciar. Según la clasificación para los diferentes tipos de solventes de Brönsted, el ácido acético glacial vendría a pertenecer a la clase protogénica, por su gran tendencia a donar protones a las especies químicas que se encuentran disueltas en él. Dada su alta estabilidad y el bajo grado de hidratación en condiciones normales de trabajo en un laboratorio, se ha convertido en el solvente protogénico más utilizado para el estudio y determinación de bases, en las cuales tiene un efecto nivelador, es decir, todas las bases fuertes en él tenderán a presentar la misma fuerza. Además de esta característica, el ácido acético glacial presenta una constante dieléctrica muy baja (6.17 a 25°C, mientras que la del agua es 78.5 a 25°C), lo cual reduce el poder disociante del medio.
Estas características hacen que la química ácido-base en este solvente sea diferente a la que se acostumbra considerar en agua. Considerando que en la industria farmacéutica y de síntesis química es común usar al ácido acético glacial como solvente, el entendimiento de su comportamiento fisicoquímico es indispensable para poder explicar y prever los procesos que se llevan a cabo dentro de este solvente.
(Bruckenstein y Kolthoff, 1956).
Aún como solvente protogénico, el ácido acético glacial tendrá ciertas características protofílicas que lo harían aceptar protones de ácidos fuertes y de la autoprotólisis limitada del medio, cuyo equilibrio viene dado por la expresión:

donde HAc representa a la molécula CH3COOH, H2Ac+ al protón solvatado CH3COOH2+, y Ac- al ion acetato CH3COO-. El valor para pKs más aceptado en la actualidad es 14.45, que es muy cercano al del agua pero que no significa que sean solventes equivalentes. Cuando se tiene una base B o un ácido HA disueltos en ácido acético glacial, se presenta un primer proceso llamado ionización, donde el soluto interactúa con las moléculas de solvente para formar pares iónicos:
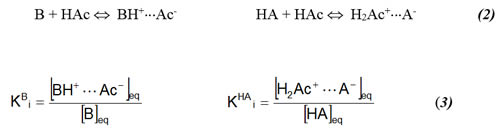
El siguiente proceso que se lleva a cabo se denomina disociación, donde el par iónico se separa para formar iones libres en solución:

Ya se ha mencionado que dada la baja constante dieléctrica de este solvente, su poder disociante es pobre, por lo que el proceso de ionización está más favorecido que el de disociación. Los valores de las constantes de equilibrio para los respectivos procesos no son fáciles de determinar experimentalmente, las técnicas de análisis nos generan resultados en términos de una combinación de los dos procesos descritos, llamada disociación total:
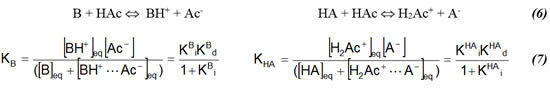
La fuerza de un ácido o una base vendría dada entonces por el análisis del proceso de disociación total y en consecuencia, de los valores para las constantes de disociación total.
La principal metodología para el análisis de bases en ácido acético glacial es la titulación potenciométrica usando ácido perclórico como titulante, dado que es el ácido más fuerte en este medio (pKHA= 4.87). A continuación se describe el análisis teórico cuantitativo para describir la evolución de un sistema de este tipo.
A pesar de que desde 1927 Conant, Hall y Werner (Conant y Hall, 1927; Hall y Conant, 1927; Hall y Werner, 1928) realizan titulaciones potenciométricas de bases y acetatos metálicos usando ácido acético glacial como solvente, no fue sino hasta 1957 cuando, después de realizar el cálculo espectrofotométrico de constantes de equilibrio de diferentes ácidos y bases en ácido acético glacial, Kolthoff y Bruckenstein (1957) desarrollan el tratamiento teórico cuantitativo de la neutralización de bases con ácido perclórico en el solvente ya mencionado. Con los datos de las constantes de equilibrio obtenidos, demostraron la validez de sus cálculos teóricos comparados con los datos experimentales; este análisis marca la partida al cálculo de constantes de equilibrio a partir de mediciones potenciométricas. A pesar de que en los años subsecuentes, algunos investigadores como Shkodin, Karkuzaki y Sadornichaya (Shkodin y Karkuzaki, 1959; Shkodin et al., 1961; Shkodin y Zadornichova, 1964) cuestionaron el trabajo de Kolthoff y Bruckenstein, poco a poco se fue consolidando éste gracias al seguimiento de numerosos investigadores como Schwarzenbach y Stenby (1959), Wegmann y Simon (1962), Tanaga y Nagasuka (1965), y más recientemente Barbosa, Cortina y Rosés (Barbosa et al., 1992a, 1992b).
A continuación se presenta el desarrollo de las ecuaciones encontradas por Kolthoff y Bruckenstein (1957). Cabe aclarar que, considerando la baja constante dieléctrica del ácido acético glacial, se usan concentraciones en lugar de actividades.
[H2Ac+] de una solución de base B. Sistema B/HAc
Ya se discutió y se planteó la expresión para la constante de disociación total de una base en ácido acético glacial:
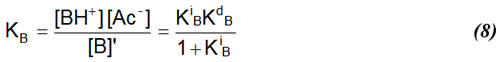
donde

Dada la baja capacidad disociante del medio, la cantidad [B]' es prácticamente igual que la concentración analítica de la base, CB.
Realizando el análisis de concentraciones al equilibrio y utilizando la reacción de disociación total se tiene:
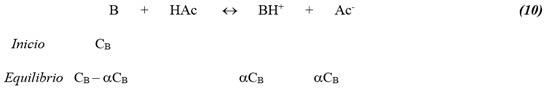
donde

de manera que la expresión de la constante de disociación total queda como:

como la base es débil en ácido acético, CB >> [Ac-]:

despejando [Ac-]:

De la autoprotólisis del ácido acético se tiene:
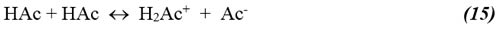
cuya constante de equilibrio (constante de autoprotólisis Ks) viene dada por:

Despejando [Ac-] de 16, sustituyendo en 14 y rearreglando se obtiene:

donde finalmente de (17) se obtiene el pH (sabiendo que pH= -log[H2Ac+]) de una solución de B en ácido acético.
[H2Ac+] en soluciones de base y su perclorato. Sistema B/HClO4/HAc
Antes del punto de equivalencia, los equilibrios de disociación total a considerar y sus respectivas expresiones para la constante de equilibrio son los siguientes:
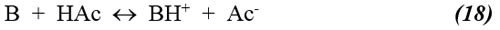
cuya expresión para la constante está dada por (8),
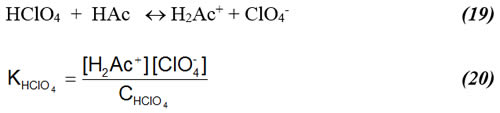
donde
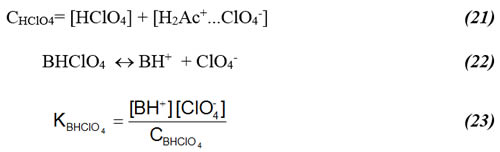
donde
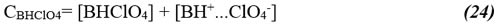
Sin embargo, el equilibrio importante en la presencia de HClO4 es la siguiente reacción de formación:
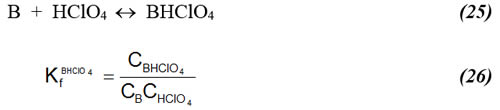
Utilizando la ley de Hess para obtener KfHClO4 a partir de (8), (16), (20) y (23) se obtiene la siguiente expresión:

Ahora, del principio de electroneutralidad se tiene:
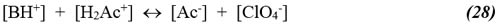
Despejando [Ac-] de (16) y sustituyendo en (8):

Sustituyendo (29) en (23):
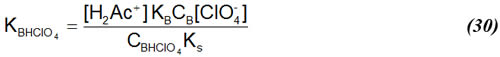
Despejando de (30) [ClO4-], [Ac-] de (16), sustituyendo estas expresiones junto con (29) en (28) y rearreglando se obtiene:
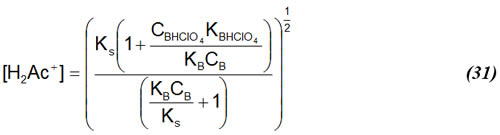
A menos que la base a titular sea tan débil que no pudiera ser titulada en ácido acético glacial, se cumple que:

Considerando esto para (31) y rearreglando una vez más, se obtiene:
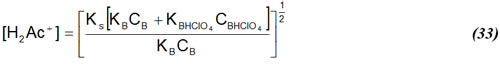
la cual es la expresión que describe los cambios de pH antes de alcanzar el punto de equivalencia. En general, es suficiente despreciar la disociación de la base, la de la sal, y la solvólisis de la sal respecto a las concentraciones totales, y asumir que CB y CBHClO4 representan las cantidades estequiométricas, es decir, asumir que la reacción (25) es bastante cuantitativa.
[H2Ac+] en soluciones de la sal pura (punto de equivalencia). Sistema BHClO4/HAc
Dado que en este punto para la mayoría de las bases se cumple que KBCB << KBHClO4 CBHClO4, considerando esto en la ecuación (31) se tiene:
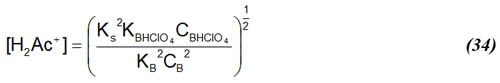
Despreciando la disociación de las especies en solución CB = CHClO4 , sustituyendo esto en (26), despejando CB2 y sustituyendo en (34):

que nos describe el pH en el punto de equivalencia. Es importante observar que según (35) el pH en el punto de equivalencia es independiente de las concentraciones de base y ácido.
[H2Ac+] en mezclas de sal y ácido perclórico en exceso. Sistema HClO4/BHClO4/HAc.
Después de alcanzado el punto de equivalencia, es conveniente expresar [H2Ac+] en términos de CHClO4 y CBHClO4.
Despejando CB de (26) y sustituyendo en la expresión resultante la ecuación (27), se obtiene:

Sustituyendo (36) en (31) y reduciendo:
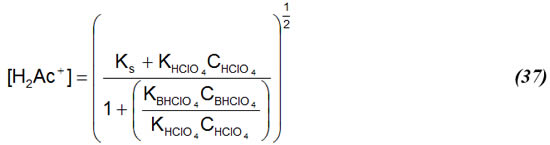
Cuando se tiene suficiente ácido en exceso en el sistema KHClO4 CHClO4 >>Ks, por lo que (37) se puede simplificar a:
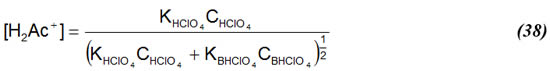
En la vecindad del punto de equivalencia, si KBHClO4 >> KHClO4 la ecuación (38) queda como:

El uso y estudio del agua como solvente en procesos químicos es común dadas las características de los procesos naturales en la Tierra, sin embargo, no es exclusiva de ella ya que otros solventes con características muy diferentes abren la puerta a investigaciones y síntesis que en agua simplemente no serían capaces de llevarse a cabo. Algunos procesos industriales donde se usan solventes no acuosos como el ácido acético glacial suelen controlarse empíricamente, por lo que un conocimiento adecuado de los procesos químicos formales que se llevan a cabo dentro de ellos es esencial para la mejora de procesos y el aumento de rendimientos en el producto final. Como se ha descrito en este ensayo, la química ácido-base del ácido acético glacial como solvente, difiere mucho de la del agua al llevarse a cabo procesos termodinámicos diferentes y que implican un replanteamiento de los equilibrios y constantes correspondientes, así como de las reacciones que se llevan a cabo en titulaciones de bases de Brönsted en este solvente. Estudios similares en otros solventes son más que necesarios para tener un entendimiento fundamental de los procesos químicos en solventes no acuosos.
Barbosa J., Cortina J. L., Rosés M., 1992a. Ionic equilibria in amphiprotic solvents of low dielectric constant: Part 1. Dissociation constants of diprotic bases in anhydrous acetic acid. Anal. Chim. Acta 256(1): 203-210.
Barbosa J., Cortina J. L., Rosés M., 1992b. Ionic equilibria in amphiprotic solvents of low dielectric constant: Part 2. Titration curves and buffer capacity of bases in anhydrous acetic acid. Anal. Chim. Acta 256(1): 211-220.
Bruckenstein S., Kolthoff I. M., 1956. Acid-Base Equilibria in Glacial Acetic Acid. III. Acidity Scale. Potentiometric Determination of Dissociation Constants of Acids, Bases and Salts. J. Am. Chem. Soc. 78(13): 2974–2979.
Conant J. B., Hall N. F., 1927. A study of superacid solutions II: A chemical investigation of the hydrogen-ion activity of acetic acid solutions. J. Am. Chem. Soc. 49(12): 3062–3070.
Hall N. F., Conant J. B., 1927. A study of superacid solutions I: The use of the chloranil electrode in glacial acetic acid and the strength of certain weak bases. J. Am. Chem. Soc. 49(12): 3047–3061.
Hall N. F., Werner T. H., 1928. A study of superacid solutions III: The titration and dilution curves of bases dissolved in acetic acid. J. Am. Chem. Soc. 50(9): 2367–2386.
Kolthoff, I. M., Bruckenstein S., 1957. Acid-Base Equilibria in Glacial Acetic Acid. IV. Quantitative Interpretation of Acid-Base Titrations in Glacial Acetic Acid. J. Am. Chem. Soc. 7(1): 1–7.
Schwarzenbach G., Stenby P., 1959. Die Acidität der schweren Halogenwasserstoffe und der Perchlorsäure in Essigsäure als Lösungsmittel, Helv. Chim. Acta 42(7): 2342-2355.
Shkodin A. M., Karkuzaki L. I., 1959. Ukr. Khim. Zh. 33: 2795-2802.
Shkodin A. M., Izmailov N. A., Karkuzaki L. I., 1961, Ukr. Khim. Zh. 27: 155-161.
Shkodin A. M., Zadornichova L. P., 1964. Izv. Vysshykh Uchebn. Zavedenii, Khim i Khim. Teknol. Zh.7: 568-574.
Tanaga M., Nagasuka G., 1965. General considerations in the acid-base titrations in glacial acetic acid: An extension of the concept of ligand buffer. Anal. Chim. Acta (33): 543-553.
Wegmann D., Simon W., 1962. Potentiometrische Mikrobestimmung von scheinbaren Dissoziationskonstanten in Essigsäure. Helv. Chim. Acta 45(3): 962-973.
[a]Profesor Investigador del Área Académica de Química de la UAEH, Miembro del Cuerpo Académico de Química Analítica y Química Física de Soluciones y Superficies. Egresado del Doctorado en Ciencias Químicas de la UAM-I. Miembro del SNI con nivel I.
[b]Profesora Investigadora del Área de Química Analítica de la UAM-I, Miembro del Cuerpo Académico de Química Analítica. Egresada del Doctorado en Ciencias Químicas de la UAM-I. Miembro del SNI con nivel III.
[c]Profesor Investigador del Área de Química Analítica de la UAM-I, Miembro del Cuerpo Académico de Química Analítica. Egresado del Doctorado en Ciencias Químicas de la UAM-I. Miembro del SNI con nivel III.