
Figura 1. Líquido iónico, cloruro de 1-(propen-2-il)-3-metilimidazolio.
Los líquidos iónicos han sido estudiados desde hace muchos años; con el paso del tiempo su síntesis, estabilidad, manejo y uso han evolucionado debido al avance en las técnicas y en la instrumentación de la investigación científica. Debido a sus propiedades fisicoquímicas específicas, estos compuestos presentan aplicaciones importantes que hoy en día los colocan como objeto importante de estudio en áreas como la química y la ciencia de los materiales.
Palabras clave: líquido iónico, presión de vapor baja, disolvente verde, catálisis, tecnología limpia
Ionic liquids have been studied since many years ago; through all those years, their synthesis, stability, handle, and usage have evolved due to the progress in technics and instrumentation in scientific research. Due to their specific physicochemical properties, these compounds have shown important applications that place them nowadays as an important object of study in areas such as chemistry and material science.
Keywords: ionic liquid, low vapor pressure, green solvent, catalyst, clean technology
Los líquidos iónicos son compuestos líquidos a temperatura ambiente (RTIL por sus siglas en inglés), por lo que se han usado como disolventes a baja presión de vapor en diferentes procesos dentro de la industria química; además, han mostrado ser excelentes catalizadores en reacciones de transformaciones orgánicas (Kadokawa, 2013), (Bäckvall & Adams, 2005). En la Figura 1 se muestra la apariencia de un RTIL.
Los IL (IL por sus siglas en inglés) son sales que tienen un componente orgánico y un componente inorgánico y que, a temperatura ambiente, o incluso a temperaturas menores que ésta, se encuentran en estado líquido (Hallett y Welton, 2011). Dicho de otra forma, son compuestos iónicos formados por un catión (especie cargada positivamente) orgánico y un anión (especie cargada negativamente) inorgánico con puntos de fusión menores a 100 ºC (Johnson, 2007; Handy, 2011). En las Figuras 2 y 3 se muestra la comparación entre una sal inorgánica (en donde, tanto el catión como el anión son especies inorgánicas) como la sal de mesa común (cloruro de sodio, NaCl, sólido), y un líquido iónico ([Bmim][NTf2], líquido a temperatura ambiente).

Figura 2. Comparación del NaCl con el líquido iónico [Bmim][NTf2] a 27ºC. Fuente: "P1010480-1s" by Zgonnik - Own work. Licensed under Public Domain via Wikimedia Commons - Link de aqui
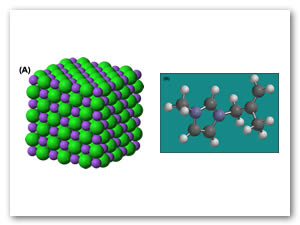
Figura 3. Comparación de las estructuras a temperatura ambiente de: (A) NaCl y (B) el líquido iónico [ProImMe]Cl. Fuentes: imagen (A): "Sodium-chloride-3D-ionic" by Benjah-bmm27 - Own work. Licensed under Public Domain via Wikimedia Commons - Link aqui
Al hablar de estos compuestos ampliamente conocidos y estudiados, es importante saber por qué son llamados "líquidos iónicos". En sus inicios los compuestos que cumplían con las características arriba descritas también fueron llamados “sales fundidas” o simplemente “fundidos”. Es así que el primer trabajo sobre este tipo de compuestos se presentó como "Estructura y propiedades de fundidos iónicos", en la reunión de la sociedad Faraday en la ciudad de Liverpool en 1961. Posteriormente surgieron trabajos donde se implementó el uso de la frase "líquidos iónicos" para referirse al mismo tipo de compuestos. Sin embargo, todavía hasta el año 2005 los términos "sales fundidas" y "líquidos iónicos" se usaban indistintamente en diferentes trabajos (Johnson, 2007), a pesar de que existen diferencias suficientes para decir que los términos se refieren a compuestos distintos (Wilkes, 2008).
Para hablar de la historia de estos compuestos debemos remontarnos hasta el año de 1914, en donde el químico ruso Paul Walden estudió por primera vez a los nitratos de alquilamonio, siendo el nitrato de etilamonio [EtNH3][NO3] el primer líquido iónico descrito; cabe recordar que en ese tiempo no se conocían con ese nombre. No fue sino hasta 30 años después, en 1948, que se describió el siguiente IL, esta vez formado por un catión de alquilpiridinio y el anión tetracloroaluminato(III) (Wilkes, 2008). Con el paso de los años se encontraron más compuestos de este tipo, pero todos con una alta sensibilidad a la humedad y por lo tanto difíciles de estudiar. No fue sino hasta inicios de los años 1990 cuando John S. Wilkes implementó el uso de aniones inorgánicos poliatómicos (aniones formados por varios átomos) como el tetrafluoroborato y el hexafluorofosfato, con los cuales aumentó la estabilidad de los compuestos y por lo tanto impulsó su estudio (Handy, 2011).
Los líquidos iónicos se diferencian entre sí por la naturaleza de los iones que los forman, es decir, se pueden hacer cientos de combinaciones si se considera por un lado, el catión orgánico -entre los cuales, los más comunes son los alquilamonio, alquilfosfonio, N-alquilpiridinio y N,N'-alquilimidazolio (siendo este último uno de los más estudiados en la actualidad)- y, por el otro lado, los diferentes aniones inorgánicos, como halogenuros, tetrafluoroborato, hexafluorofosfato, triflato, triflimida y dicianimida, entre otros. De tal forma que debido a la libertad en el diseño del catión orgánico (por ejemplo, por variación de la longitud de la cadena lateral o mediante la variación de los sustituyentes en el anillo y en la cadena) y la posible combinación de cationes y aniones, se puede generar un número enorme de diferentes líquidos iónicos (Cassol et al., 2006; Handy, 2011). En la parte superior de la Figura 4, se muestra la estructura del IL [C3H3N2RR'][BF4], así como la estructura de algunos de los cationes y aniones más comunes que pueden ser intercambiados para formar diferentes IL.
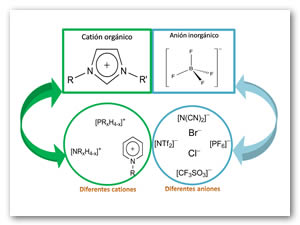
Figura 4. Ejemplo de la estructura del líquido iónico [C3H3N2RR'][BF4], y los cationes y aniones más utilizados en la formación de IL.
Una de sus primeras aplicaciones de este tipo de compuestos es como disolventes de materiales orgánicos e inorgánicos debido a que al estar formados por iones, en su mayoría poco coordinantes, son altamente polares y no son miscibles en disolventes orgánicos. Así, son una alternativa no acuosa en reacciones químicas, tienen una presión de vapor muy baja, por lo que no son volátiles (Hallett & Welton, 2011) y pueden disolver complejos metálicos, compuestos orgánicos y gases difíciles de disolver con disolventes convencionales (Dyson, 2002). Una ventaja importante de usar líquidos iónicos como disolventes es que, al ser poco volátiles, se disminuye en gran medida la contaminación en comparación con los disolventes orgánicos usados comúnmente que pueden vaporizarse a la atmosfera (Dyson & Geldbach, 2007). Por tal motivo, a los IL también se les conoce como “disolventes verdes”, dentro de la llamada “química verde” (Figura 5). A diferencia de los aproximadamente 600 disolventes convencionales que son ampliamente utilizados en procesos industriales y sintéticos, los IL existen en por lo menos un millón de formas puras y un billón de mezclas ternarias. Esta libertad permite diseñar estos materiales para realizar u optimizar una tarea específica, razón por la que a los IL se les ha denominado "disolventes de diseño" (Handy, 2011).
Otra aplicación importante de los líquidos iónicos es en reacciones catalíticas de metales de transición; para este tipo de reacciones, los líquidos iónicos más utilizados son los N,N'-alquilimidazolio (Figura 6), que por sus características electrónicas y estéricas logran retener el catalizador, con lo cual se incrementa su reactividad y al mismo tiempo se facilita su recuperación (Glorious, 2006). Esto último se refleja en el desarrollo de una "tecnología limpia", en donde se reduce la cantidad de desechos generados en las industrias y se disminuye el uso de disolventes volátiles (Seddon, 1997; Wilkes, 2008).

Figura 6. Ejemplo del proceso de retención de un catalizador por parte de un líquido iónico, en donde se lleva a cabo la reacción catalítica.
Cuando se habla de nuevas tecnologías para la obtención de energía, actualmente los líquidos iónicos juegan un papel muy importante, ya que debido a su baja volatilidad y capacidad disolvente, se están empleando como absorbentes del CO2 producido al obtener energía, para así evitar que éste alcance la atmósfera como contaminante. Por otra parte, se busca la obtención y almacenamiento de energía a partir de estos compuestos mediante la fabricación de celdas solares o el desarrollo de pilas de combustible de membrana de intercambio de protones (Figura 7) o el mejoramiento de baterías de Li, Na y Mg (Smiglak, et al., 2014).

Figura 7. Celda de combustible. Fuente: "Fuel cell NASA p48600ac". Licensed under Public Domain via Wikimedia Commons - Link aqui
Smiglak et al. (2014) describen también la aplicación de los líquidos iónicos en el área de los materiales, en donde los IL se utilizan por su alta estabilidad térmica, como tamices moleculares, armazones organometálicos o fotocatalizadores, entre otras aplicaciones importantes. Sin embargo, el alcance de estos compuestos es todavía mayor, al tener también una aplicación importante en la industria farmacéutica y agrícola, en las que se promueve el diseño de líquidos iónicos de baja toxicidad, que sean biodegradables y presenten actividad biológica, con la finalidad de obtener nuevos medicamentos y agroquímicos de mayor eficiencia.
En el trabajo de Smiglak et al. (2014), se menciona que el progreso en el estudio de la naturaleza fundamental y nuevas aplicaciones de los IL, está permitiendo no solo considerar a estas especies como disolventes “verdes”, sino como materiales con propiedades únicas y sintonizables que se pueden ajustar al seleccionar los iones adecuados para una necesidad específica. Esta propiedad única para ajustar las propiedades hace a los IL muy atractivos en una extensa gama de áreas de aplicación, que pueden ir desde la ciencia de los materiales hasta la electroquímica o desde la catálisis hasta la química medicinal.
Como se ha descrito en este ensayo, existe a la fecha una gran cantidad de trabajos en diferentes áreas de la química en los que se aprovechan las características y propiedades importantes que tienen los líquidos iónicos, pero aun así el campo de investigación sobre estos compuestos es muy amplio y promete encontrar en los líquidos iónicos una alternativa para resolver problemas actuales como: la optimización de procesos químicos de interés industrial, la obtención de energía limpia y renovable o el tratamiento de la contaminación, entre muchas otros.
Bäckvall, J., Adams, R. (2005) Organometallic chemistry in ionic liquids. Journal of Organometallic Chemistry, 3489-3626.
Cassol, C. C., Ebeling, G., Ferrera, B., Dupount, J. (2006) A Simple and Practical Method for the Preparation and Purity Determination of Halide-Free Imidazolium Ionic Liquids. Advanced Synthesis and Catalysis, 243-245.
Dyson, P. J. (2002) Transition metal chemistry in ionic liquids. Transition Metal Chemistry, 353-354.
Dyson, P. J., Geldbach, T. J. (2007) Applications of Ionic Liquids in Synthesis and Catalysis. The Electrochemical Society Interface, 50-52.
Glorious, F. (2006) N-Heterocyclic Carbenes in Catalysis—An Introduction. Topics in Organometallic Chemistry, 1-6.
Hallett, J. P., Welton, T. (2011) Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis. 2. Chemical Reviews, 3508-3576.
Handy, S. T. (2011) Classes of Ionic Liquids. En S. T. Handy, Ionic Liquids – Classes and Properties (págs. 3-4). Rijeka, Croacia: InTech.
Johnson, K. E. (2007) What´s an Ionic Liquid? The Electrochemical Society Interface, 38-41.
Kadokawa, J. I. (2013) Ionic Liquids- New Aspects for the Future. [Versión Adobe Digital editions]: DOI: 10.5772/45605.
Seddon, K. R. (1997) Ionic Liquids for Clean Technology. Journal of Chemical Technology and Biotechnology, 351-355.
Smiglak, M., Pringle, J., Lu, X., Han, L., Zhang, S., Gao, H., y otros. (2014) Ionic liquids for energy, materials, and medicine. Chemical Communications, 2928-2945.
Wilkes, J. S. (2008) Introduction. En: Ionic Liquids in Synthesis (P. Wasserscheid y T. Welton, eds.), pp. 1-6. Wiley VCH, Weinheim, Alemania.
Wilkes, J. S. (2004) Properties of ionic liquid solvents for catalysis. Journal of Molecular Catalysis A: Chemical, 11-17.
[a] Estudiante de Maestría en Química. Área Académica de Química (AAQ).correo-e:danielomar_h16@hotmail.com; mariana_carpiog@hotmail.com
[b] Profesor Investigador Titular. Área Académica de Química (AAQ). correo-e: fjzuno@gmail.com; gloriasa@uaeh.edu.mx.