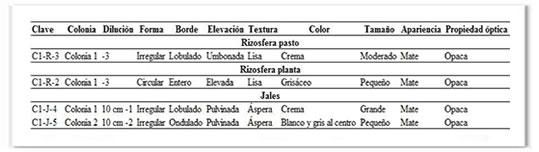
Tabla 1. Morfología colonial de cepas aisladas en Mineral de la Reforma, Hidalgo.
Hidalgo es reconocido por su actividad minera. La extracción de minerales de interés económico genera residuos llamados jales; estos se depositan a la intemperie y son una fuente de contaminación para la atmósfera, suelo y agua. La fitorremediación consiste en usar plantas capaces de inmovilizar, acumular, volatilizar o asimilar metales pesados producidos por la minería. La asociación de ciertas bacterias a raíces de plantas contribuye a dichos procesos. En esta investigación se aislaron y caracterizaron grupos bacterianos de jales y raíces de plantas que crecen sobre ellos. Se tomaron muestras de jales y de rizosfera de algunas plantas del depósito de Dos Carlos en Mineral de la Reforma y de una presa de jales en operación en Zimapán. Se realizaron diluciones decimales seriadas para cuantificar unidades formadoras de colonias. Se seleccionaron un total de veinte colonias de ambos sitios de muestreo para conocer su forma, borde, elevación, textura y color y se resembraron para conformar un cepario. Se tiñeron por la técnica de Gram y se obtuvieron micrografías. También se caracterizaron bioquímicamente por IMVIC, reducción de nitratos; hidrólisis de caseína, almidón y gelatina; sulfuro y catalasa. Los resultados muestran una variedad de grupos bacterianos respecto a la morfología colonial y pruebas bioquímicas. Algunas cepas sugieren la presencia de actinobacterias debido a su forma filamentosa.
Palabras clave: jales, fitorremediación, rizosfera, metales pesados, actinobacterias
Hidalgo is recognized by its mining activities. The mining of minerals of economic value generates wastes known as tailings; these are deposited outdoors, and they are a source of pollution for the atmosphere, soil and water. Phytoremediation is the use of plants able to immobilize, accumulate, volatilize or assimilate heavy metals produced by mining. The association of certain bacteria with the roots of plants contribute to these processes. In the present work bacterial groups associated with tailings and the roots of plants growing on them were isolated and characterized. Samples of tailings and plant rizosphere were taken from the Dos Carlos deposit in Mineral de la Reforma and from an active tailings pile in Zimapán. Serial decimal dilutions were performed to quantify colony forming units. Twenty colonies were selected of both sampling sites to evaluate their shape, margin, elevation, texture, and color characterization and to conform a culture collection. The strains were Gram stained and microphotographed. The strains were biochemically characterized using IMVIC, nitrates reduction; casein, starch and gelatin hydrolysis; sulfide and catalase. The results showed a variety of bacterial groups according to colonial morphology and biochemical tests. Some strains suggest the presence of actinobacteria due to their filamentous shape.
Keywords: tailings, phytoremediation, rizosphere, heavy metals, actinobacteria
Hidalgo es un estado de gran tradición minera, de donde se han extraído principalmente oro, plata, plomo, cobre, zinc, manganeso y mercurio; estos minerales de importancia económica son exportados e importados para su industrialización y comercialización (Hernández-Acosta et al., 2009).
Las actividades mineras traen consigo la generación de una gran cantidad de residuos como resultado de las operaciones de separación y concentración de minerales. De acuerdo con la NOM-141-SEMARNAT-2003, estos residuos se denominan jales (DOF, 2004) y son de importancia ambiental porque en su composición pueden presentar elementos tóxicos y potencialmente tóxicos. Se consideran tóxicos aquellos elementos que no desempeñan una función biológica y que provocan efectos adversos en los seres vivos, aún en concentraciones traza. Arsénico, plomo, cadmio y mercurio son ejemplos de elementos tóxicos. Los elementos potencialmente tóxicos (EPT), como zinc, hierro y cobre, sí cuentan con una función biológica; no obstante, en altas concentraciones son perjudiciales para los organismos (Manahan, 2000; Romero, 2011).
En el estado de Hidalgo existen jales, como los de Zimapán, que contienen elementos tóxicos como plomo y arsénico. La actividad minera en Zimapán inició desde el siglo XVI con la explotación de óxidos y sulfuros (Saavedra y Sánchez, 2008).
A pesar de que los jales son lugares contaminados, existen plantas metalofitas con mecanismos que les permiten vivir en estos ambientes. Se ha comprobado que estas plantas viven en simbiosis con microorganismos que tienen un papel importante en la rizosfera (Marrero-Coto et al., 2012). De acuerdo con Volke y Velasco (2002), existen microorganismos que participan activamente en procesos de acumulación de elementos químicos. Generalmente estos microorganismos presentan un rápido crecimiento y capacidad para almacenar metales en su biomasa; también se ha observado que pueden aumentar la disponibilidad y movilidad de los metales mediante la producción de ácidos orgánicos y sideróforos, que son compuestos quelantes secretados por los microorganismos que ayudan en la asimilación de metales como el hierro (Marrero-Coto et al., 2012).
La biorremediación es una tecnología que consiste en promover procesos naturales de los organismos o microorganismos para la recuperación de lugares contaminados (Bernal et al.,2007). Existen técnicas de biorremediación in situ y ex situ como la fitorremediación, que implica el uso de plantas para controlar contaminantes y tratar de recuperar la calidad del sitio (Carpena y Bernal, 2007).
Realizar estudios de la diversidad microbiana presente en los jales de Zimapán y Mineral de la Reforma, Hidalgo, es un área de oportunidad para conocer el potencial de estos microorganismos en técnicas de biorremediación, como la fitorremediación. En el presente trabajo se pretende identificar bacterias en jales y bacterias asociadas a raíces de plantas metalofitas en jales, mediante su aislamiento, cultivo y cuantificación, para conocer su morfología colonial y caracterizarlas bioquímicamente.
Se han estudiado diversos microorganismos que modifican las especies iónicas metálicas para incrementar su solubilidad; un ejemplo es Arthrobacter ramosus, que indujo un cambio en la especiación de algunos iones metálicos. Algunas alfaproteobacterias propician la movilización y disponibilidad de metales pesados para su acumulación en plantas metalofitas. En un estudio realizado en Punta Gorda, España, se aislaron bacterias heterótrofas de los géneros Bacillus y Pseudomonas que demostraron ser resistentes al dióxido de níquel y al dióxido de carbono (Marrero-Coto et al., 2012). Otras especies bacterianas aisladas de suelos contaminados, en donde se observó que juegan un papel importante en la asimilación de metales, son: Burkholderia pickettii, Burkholderia solanacearum, Alcaligenes eutrophus, Arthrobacter ramousus y Arthrobacter aurescens, así como taxones de los géneros Hafnia, Pseudomonas, Acinetobacter, Comamonas y Agrobacterium (González-Chávez, 2005).
Breuil y Kushner (1980, citado por Riojas et al., 2010) señalan la importancia del empleo de surfactantes en la biorremediación. Estos investigadores observaron que algunos surfactantes como tritón X-100, FI-70, 75 y Brij potencian el crecimiento de Pseudomonas aeruginosa. También se ha reportado que existen microorganismos que degradan contaminantes orgánicos presentes en agua y suelo, por ejemplo: Pseudomonas sp., Achromobacter, Acinetobacter, Alcaligenes, Arthrobacter, Flavobacterium y Nocardia (Leahy y Colwell, 1990, citado por Riojas et al., 2010).
Se definieron los sitios de muestreo en Mineral de la Reforma y Zimapán, Hidalgo. En Mineral de la Reforma se estableció un centro metalúrgico en 1550; de ahí se extraían minerales como el Cu, Zn, Pb, Ag y Au (SGM, 2011). Es un municipio localizado a 20º8’8" latitud norte y 98º40’19" longitud oeste, entre 2400-2800 m.s.n.m.; cuenta con un clima semiárido y templado, con lluvias en junio, julio, agosto y septiembre. La vegetación predominante está constituida de acacias, mezquites, magueyes, nopaleras, cactus, biznagas, huizaches y pirules (H. Ayuntamiento de Mineral de la Reforma, 2015).
El otro sitio de estudio, Zimapán, tiene tradición minera desde 1632. Se localiza a 20º44’ latitud norte, 99º23’ longitud oeste y a 1780 m.s.n.m.; presenta un clima templado con un periodo de lluvias de mayo a junio y predomina la vegetación de climas áridos como biznagas, hortigas, mezquites, magueyes, órganos, cardones, nopaleras y acacias (H. Ayuntamiento de Zimapán, 2015).
En Mineral de la Reforma, las muestras se tomaron en la zona este del depósito de Jales Dos Carlos (N 20º06’21.6", W 98º42’30.24"), que es una de las áreas que se habían considerado anteriormente para un estudio previo de erosión hídrica realizado en la zona (Zamora et al., 2014). Los muestreos en Zimapán se realizaron en la Compañía Minera Beneficiadora Purísima, S. de R.L de C.V, mina en operación que produce concentrados de sulfuro de zinc, plomo y cobre, en la presa de jales número 3 (N 20º43’34.5", W 99º23’29.1"), la cual llegó a su límite de capacidad, y en la presa de jales 4 (N 20º43’34.8", W 99º23’27.1"), actualmente en operación. En ambos sitios de estudio las muestras simples de jales se tomaron a tres profundidades (10 cm, 25 cm y 50 cm) con una pala cuadrada y se recolectaron en bolsas microbiológicas estériles. Con un flexómetro se midió la profundidad y con un termómetro la temperatura del ambiente y del suelo. Para las muestras de rizosfera, en ambos sitios, se tomó la planta completa evitando la pérdida del suelo que rodea a la raíz y se depositó en bolsas de plástico con cierre hermético; cada muestra recolectada se etiquetó con los siguientes datos: fecha de recolección, lugar, coordenadas y temperatura; para el caso de muestras de jales se registró la profundidad a la cual se tomó la muestra.
Las muestras se trasladaron al laboratorio para su análisis microbiológico, que consistió en: diluciones decimales seriadas hasta la 1x10-3, cuantificación de microorganismos por el método de conteo en placa, aislamiento de unidades formadoras de colonias (UFC) para la obtención de cultivos puros, con siembra en duplicado por extensión de placa, formación de cepario y caracterización morfológica, la cual se realizó con la observación directa de la colonias seleccionadas que fueron aisladas en agar nutritivo con extracto de suelo en tubo inclinado; por último, se llevó a cabo la caracterización morfológica y bioquímica. Se realizó tinción de Gram para conocer la morfología microscópica, utilizando un microscopio de contraste de fases (Olympus CH30) y observando las muestras con aceite de inmersión a 100x, en campo claro y campo oscuro; se obtuvieron micrografías de las cepas aisladas.
Para la caracterización morfológica de las UFC se tomaron criterios como: borde, forma, textura, elevación, color, tamaño, apariencia y propiedad óptica de acuerdo con Steve y Strete (2001). Para la morfología microscópica se determinaron diversas formas, como cocos, bacilos y filamentos. Para la caracterización bioquímica se realizaron las siguientes pruebas: producción de sulfuro (H2S), Voges-Proskauer (VP), rojo de metilo (RM), hidrólisis de caseína, hidrólisis de almidón, hidrólisis de gelatina, reducción de nitratos, catalasa, indol y movilidad, según Ramírez-Gama et al. (1998). Se emplearon cepas certificadas de Bacillus subtilis CDBB-B 1009 y Escherichia coli ATCC 35218 como testigos para las pruebas bioquímicas.
Solo se consideraron las cajas entre 30 y 300 UFC, como se establece en la NOM-092-SSA1-1994 (DOF, 1995). De las 30 cajas sembradas a partir de las diluciones decimales seriadas para el jal de Mineral de la Reforma, dos rebasaron el parámetro mencionado y solo cinco presentaron UFC dentro de los parámetros considerados por la norma. En el caso del jal de Zimapán, siete de las 42 cajas sembradas se encontraban dentro de los parámetros de la norma. El promedio de UFC/g que se obtuvo para Mineral de la Reforma fue de 6.5x105, mientras que para Zimapán fue de 3.8x105.
Respecto a la morfología colonial, los resultados obtenidos indican que la mayoría de las cepas de ambos sitios crecen en colonias con forma irregular y circular. Sin embargo, la diversidad de coloración en las colonias aisladas en Mineral de la Reforma es menor en comparación con la coloración de las aisladas de Zimapán (Tablas 1 y 2). En cuanto a características como el borde, elevación y tamaño, los resultados no fueron similares en los dos sitios; respecto a la textura y apariencia solo se consideraron dos opciones para cada caso (Tablas 1 y 2).
En la caracterización bioquímica (Tabla 3) se obtuvo que todas las cepas presentaron un resultado negativo para la producción de sulfuro e indol; para la producción de catalasa y reducción de nitratos, la mayoría de las cepas resultaron positivas. En las pruebas de hidrólisis de caseína, hidrólisis de gelatina, Voges-Proskauer, rojo de metilo y movilidad, solo una porción de las cepas resultó ser positiva. En la prueba de hidrólisis de almidón una cepa no mostró crecimiento.
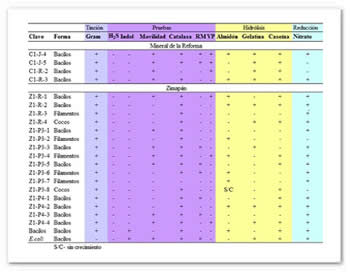
Tabla 3. Pruebas bioquímicas realizadas para las distintas cepas. +: positivo, -: negativo, S/C: sin crecimiento.
Como se observa en la Figura 1, las micrografías obtenidas muestran diversas formas microscópicas, tales como cocos, bacilos y filamentos.
Los microorganismos juegan un papel determinante en los diversos procesos que ocurren en el suelo y la contaminación no es la excepción. Los contaminantes pueden afectar directa e indirectamente la microbiota del suelo y, a su vez, los microorganismos actúan sobre los contaminantes, degradándolos cuando son de naturaleza orgánica o afectando su solubilidad y biodisponibilidad, como ocurre con los metales. El suelo cuenta con un aproximado de 1x109 a 1x1010 microorganismos por gramo (Madigan et al., 2004, citado por Salazar y Ordóñez, 2013), de los cuales, aproximadamente 1x106 a 1x107 pertenecen al phylum Actinobacteria (Sylvia et al., 1999 citado por Salazar y Ordóñez, 2013). De acuerdo con los resultados obtenidos, encontramos que en la rizosfera existen 1x108 microorganismos por gramo. De acuerdo con Pelaz (2014) las actinobacterias son un grupo de bacterias presentes en el suelo, rizosfera, agua salada, agua dulce, estiércol y composta; también pueden aislarse de animales, incluso del humano. Vega (1998) considera que lo primero en tomar en cuenta para identificar una actinobacteria es la morfología microscópica y el resultado de las tinciones. Como explica Pelaz (2014), las actinobacterias, morfológicamente, son parecidas a los hongos debido a la presencia de hifas filamentosas que producen esporas. Según los resultados obtenidos, algunas de las cepas aisladas probablemente se traten de actinobacterias, ya que cuentan con esa morfología filamentosa. No obstante, algunas actinobacterias también cuentan con morfología de bacilos o cocos (Fernández, 2005 citado por Pelaz, 2014).
Como mencionan Torres-Beltrán et al. (2012), las actinobacterias se caracterizan por mostrar un resultado positivo en la tinción de Gram que, de acuerdo con Ramírez-Gama et al. (1998), es una prueba que permite conocer características de la composición de la pared celular y los requerimientos nutricionales de la bacteria. Existen excepciones que no resultan en bacterias Gram positivas, como los géneros Nocardia y Rhodococcus, que son ácido-alcohol resistentes y por lo que es necesario realizarles tinciones como la de Zhiel Neelsen (Vega, 1998). Otros trabajos de aislamiento de microorganismos rizosféricos presentes en lugares contaminados describen formas de bacilos Gram negativos ; en cambio, nuestros resultados arrojan bacilos Gram positivos en su mayoría, al igual que lo reportado por Salgado (2012). Estos resultados se encuentran en función de la composición de la microbiota determinada por las plantas y de factores ambientales del suelo (Münch et al., 2007, citado por Salgado, 2012).
La caracterización bioquímica ayuda a la diferenciación de actinobacterias entre géneros e incluso especies; por ejemplo, Nocardia brasiliensis hidroliza la caseína, mientras Nocardia asteroides no. La mayoría de las actinobacterias aerobias hidrolizan la gelatina y reducen nitratos (Vega, 1998). Como se observa en la mayoría de las cepas aisladas, la hidrólisis de caseína y la reducción de nitratos fueron pruebas con resultados variados; se obtuvieron resultados positivos para más de la mitad de las cepas, mientras que para la prueba de hidrólisis de gelatina 11 de las 20 cepas aisladas resultaron negativas. Pruebas como la de la catalasa resultaron positivas para 18 de las 20 cepas aisladas; la catalasa es una enzima que actúa sobre el peróxido de hidrógeno que se forma por la oxidación de los carbohidratos (Ramírez-Gama et al., 1998), descomponiéndolos en agua y oxígeno; sin esta enzima el peróxido de hidrógeno sería mortal para los microorganismos (Granados y Villaverde, 1997).
Se logró la cuantificación de grupos bacterianos presentes en la rizosfera y jales, y se obtuvieron cultivos puros que ayudaron a caracterizar bioquímicamente las cepas obtenidas. La diversidad morfológica de las cepas aisladas en Zimapán es mayor que la de las cepas aisladas en Mineral de la Reforma. Entre las cepas aisladas se encontraron algunas formas filamentosas y positivas para la tinción de Gram, lo que sugiere la posible presencia de actinobacterias. Con los resultados obtenidos y las actividades que se realizarán para completar este estudio, esperamos encontrar aspectos interesantes en algunas de las cepas aisladas para proponerlas como bacterias con potencial en técnicas de fitorremediación, y contribuir con literatura que pueda aportar conocimiento a estudios posteriores.
Bernal, M. P., Clemente, R., Vázquez, S., Walker, D. J. (2007) Aplicación de la fitorremediación a los suelos contaminados por metales pesados en Aznalcóllar. Revista Ecosistemas, 16(2), 68-82.
Carpena, R. O., Bernal, M. P. (2007) Claves de la fitorremediación: fitotecnologías para la recuperación de suelos. Revista Ecosistemas, 16(2), 1-3.
DOF (2004) Norma Oficial Mexicana NOM-141-SEMARNAT-2003, que establece el procedimiento para caracterizar los jales, así como las especificaciones y criterios para la caracterización y preparación del sitio, proyecto, construcción, operación y post operación de presas de jales. Secretaría del Medio Ambiente y Recursos Naturales, México, publicada el 13 de septiembre de 2004.
DOF (1995) Norma Oficial Mexicana NOM-092-SSA1-1994, que establece el método para estimar la cantidad de microorganismos viables presentes en un alimento, agua potable y agua purificada, por la cuenta de colonias en un medio sólido, incubando aeróbicamente. Secretaría del Medio Ambiente y Recursos Naturales, México, publicada el 12 de diciembre de 1995.
González-Chávez, M. D. (2005) Recuperación de suelos contaminados con metales pesados utilizando plantas y microorganismos rizosféricos. Terra Latinoamericana, 23(1), 29-37.
Granados, P. R., Villaverde, M. C. (1997) Microbiología. Paraninfo. Madrid, España, 365 pp.
H. Ayuntamiento de Mineral de la Reforma (2015) Enciclopedia de los Municipios y Delegaciones de México. Estado de Hidalgo [en línea]. Link de acceso
H. Ayuntamiento de Zimapán. (2015) Enciclopedia de los Municipios y Delegaciones de México. Estado de Hidalgo [en línea]. Link de acceso
Hernández-Acosta, E., Mondragón-Romero, E., Cristobal-Acevedo, D., Rubiños-Panta, J. E., Robledo-Santoyo, E. (2009) Vegetación, residuos de mina y elementos potencialmente tóxicos de un jal de Pachuca, Hidalgo, México. Revista Chapingo, Serie Ciencias Forestales y del Ambiente, 15(2), 109-114.
Manahan, S. E. (2000) Environmental Chemistry, 7th Ed. Lewis Publishers, Washington, D. C., 877 pp.
Marrero-Coto, J., Amores-Sánchez, I., Coto-Pérez, O. (2012) Fitorremediación, una tecnología que involucra a plantas y microorganismos en el saneamiento ambiental. ICIDCA, 46(3), 52-61.
Pelaz, G. G. (2014) Aislamiento y estudio de la diversidad de las poblaciones de Actinobacterias presentes en muestras de compost. Tesis de licenciatura. Universidad de Salamanca, España.
Ramírez-Gama, R. N., Luna, M. B., Mejía, C. A., Velázquez, M. O., Tsuzuki, R. G., Vierna, G. L., Hernández, G. L., Müggenburg, I. (1998) Manual de Prácticas de Microbiología General. Facultad de Química, UNAM, México, 300 pp.
Riojas, G. H. H., Torres, B. L. G., Mondaca, F. I., Balderas, C. J. J. Gortáres, M. P. (2010) Efectos de los surfactantes en la biorremediación de suelos contaminados con hidrocarburos. Química Viva, 9(3), 120-145.
Romero, G. J. A. (2011) Geoquímica de As, Hg, Pb y Zn y mineralogía en sedimentos superficiales de la cuenca de drenaje del distrito minero El Triunfo, B. C. S., México. Tesis de maestría. Instituto Politécnico Nacional, México.
Saavedra, S. E., Sánchez, S. M. (2008) Minería y espacio en el distrito minero Pachuca-Real del Monte. Investigaciones Geográficas, 65, 82-101.
Salazar, L. A. M., Ordóñez, G. C. A. (2013) Aislamiento e identificación de Actinomicetos fijadores de nitrógeno en suelo del jardín botánico de la Universidad Tecnológica de Pereira. Tesis de licenciatura. Universidad Tecnológica de Pereira, Colombia.
Salgado, B. I. (2012) Remoción de contaminantes de aguas residuales por rizobacterias autóctonas con aplicación en humedales artificiales. Tesis de doctorado. Universidad de la Habana, Cuba.
SGM (2011) Panorama minero del estado de Hidalgo. Servicio Geológico Mexicano [en línea]. http://www.sgm.gob.mx/pdfs/HIDALGO.pdf
Steve, K. A., Strete, D. (2001) Microbiology: A Photographic Atlas for the Laboratory. Benjamin Cumming, 193 pp.
Torres-Beltrán, M., Cardoso-Martínez, F., Millán-Aguiñaga, N., Becerril-Espinosa, A., Soria-Mercado, I. E. (2012) Evaluación del Golfo de California como una fuente potencial de actinobacterias marinas bioactivas. Ciencias Marinas, 38(4), 609-624.
Vega, A. A. S. (1998) Diferenciación de actinomicetos mediante el análisis de ácidos micólicos, Tesis de maestría. Universidad Autónoma de Nuevo León, México.
Volke, S. T., Velasco, T. J. A. (2002) Tecnologías de remediación para suelos contaminados. Instituto Nacional de Ecología (INE). México, 64 pp.
Zamora, J. J., Segovia, N., González, M. R., Lizárraga, L. G. (2014) Estimación de la erosión hídrica de los jales de Dos Carlos, Mineral de la Reforma, Hidalgo. Residuos sólidos y peligrosos. Memorias del XXXIV Congreso Interamericano AIDIS . Monterrey, N. L., México, 2-6 de noviembre.
[a] Alumna de la Licenciatura en Biología, del Área Académica de Biología.
[b] Profesora Investigadora de Tiempo Completo del Área Académica de Ingeniería. Ingeniera Química egresada de la UNAM, graduada en Maestría y Doctorado en Ingeniería (Ambiental y Química, respectivamente) del Programa de Maestría y Doctorado de la UNAM. Sus líneas de investigación son la ingeniería ambiental, la geoquímica y el desarrollo sustentable.
[c] Profesora Investigadora del Área Académica de Química. Doctora en Ciencias con especialidad en Biotecnología Ambiental por el CINVESTAV, México. Sus temas de investigación son la dinámica de nutrientes y contaminantes en suelos, la recuperación de suelos y el biomonitoreo atmosférico.
[d] Técnico del Área Académica de Biología.
[e]Profesora Investigadora del Área Académica de Química. Doctora en Ordenación del Territorio y Medio Ambiente por la Universidad Politécnica de Madrid, España. Su investigación se enfoca en la diversidad microbiana del agua y en la calidad de aguas residuales de reúso. Correo electrónico del autor de correspondencia: ccoronel@uaeh.edu.mx