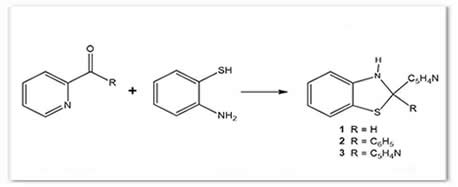
Esquema 1. Síntesis de hidrobenzotiazoles 2-piridin-sustituidos 1 – 3
En el presente trabajo de investigación se describe el estudio de las interacciones por puente de hidrógeno en tres hidrobenzotiazoles 2-piridin sustituidos del tipo {(C6H4CSNH)(C5H4N)R} [(1), R = H; (2), R = C6H5; (3), R = C5H4N], utilizando la Resonancia Magnética Nuclear (RMN), espectroscopía infrarroja y difracción de rayos X de monocristal. Para los compuestos 2 y 3, los datos de RMN de 1H en solución de CDCl3 mostraron el predominio de un enlace por puente de hidrógeno intramolecular que se forma entre el átomo de hidrógeno del grupo NH con el átomo de nitrógeno del grupo piridínico (NH•••N), lo que da lugar a la formación de un anillo de cinco miembros, mientras que para 1 – 3 en solución de DMSO-d6 se ha establecido la presencia de puentes de hidrógeno intermoleculares del tipo NH•••OS(CH3)2. Asimismo, en estado sólido, las interacciones intramoleculares del tipo (NH•••N) también han sido establecidas por infrarrojo y difracción de rayos X de monocristal.
Palabras clave: Enlace de hidrógeno, RMN, difracción de rayos X de monocristal, hidrobenzotiazoles
In this work, the study of hydrogen bonds in the hydrobenzothiazoles 2-pyridin substituted of general formula {(C6H4CSNH)(C5H4N)R} [(1), R = H; (2), R = C6H5; (3), R = C5H4N] in solution and solid state by NMR, infrared and X-ray diffraction is described, Figure 1. On the one hand, for 2 and 3, the 1H NMR data in CDCl3 solution displayed the predominance of an intramolecular hydrogen bonding NH•••N that is formed between the hydrogen atom of the NH group with the pyridinic nitrogen atom forming a five-membered ring. On the other hand, the 1H NMR spectra of 1 – 3 in DMSO-d6 solution showed the formation of intermolecular hydrogen bonds of type NH•••OS(CH3)2. In solid state, the NH•••N intramolecular hydrogen bonding for 1 – 3 by infrared and X-ray diffraction has been also established.
Keywords: Hydrogen bonds, 1H NMR, X-ray diffraction, hydrobenzothiazoles
Los enlaces por puente de hidrógeno intermoleculares son de interés biológico debido a que forman parte de la estructura secundaria de péptidos como la hélice-α (Dannenberg, 2005), mientras que los enlaces de hidrógeno intramoleculares, debido a la rigidez que proporcionan a las moléculas de estudio, han sido utilizados en la construcción de nuevos materiales (Zhan-Ting et al., 2008) que tienen una mayor conjugación-π y cuyo empaquetamiento cristalino a lo largo de alguno de los ejes le otorga propiedades conductoras (Yuan et al., 2004; Yong-Hui y Kertesz, 2009). Con respecto a la síntesis, caracterización y estudio de derivados hidrobenzotiazólicos, existe un amplio interés debido a que la presencia del átomo de azufre le proporciona a estos compuestos una reactividad característica, por lo que han sido utilizados en la síntesis de nuevos compuestos que contienen grupos funcionales como tiazoles, β-aminotioles, aldehídos y cetonas, entre otros (Gaumont et al., 2009). Asimismo, la evaluación de los enlaces por puente de hidrógeno en hidrobenzotiazoles puede contribuir a explicar su comportamiento hacia la coordinación metálica. Por lo anterior, en este trabajo se describe el estudio de las interacciones intra- e intermoleculares por puente de hidrógeno en los hidrobenzotiazoles 1 – 3,utilizando diferentes técnicas como espectroscopía infrarroja, RMN de 1H y difracción de rayos X de monocristal.
Los reactivos utilizados 2-aminotiofenol, 2-piridincarboxaldehído, 2-fenilpiridilcetona, 2,2-dipiridilcetona, diclorometano, ácido sulfúrico y sulfato de sodio, así como los disolventes deuterados DMSO-d6 y CDCl3 fueron adquiridos comercialmente (Sigma Aldrich). Todas las manipulaciones se llevaron a cabo utilizando disolventes previamente purificados mediante métodos convencionales y por técnicas Schlenk. Los puntos de fusión fueron determinados en un aparato Mel-Temp II y se reportan sin corregir. El análisis elemental para 2 y 3 fue obtenido en un equipo Perkin Elmer-Series II CHNS/O Analyzer 2400. Los espectros de IR fueron obtenidos en un espectrofotómetro FT-IR 200 Perkin Elmer en el intervalo de 4,000 a 400 cm−1, en pastillas de CsCl. Los espectros de RMN de 1H se obtuvieron en un espectrómetro Varian VNMRS 400 utilizando DMSO-d6 y CDCl3. Los desplazamientos químicos para el núcleo de 1H se reportan con respecto a la frecuencia interna de tetrametilsilano (TMS). Las estructuras cristalinas de 2 y 3 fueron determinadas a temperatura ambiente en un difractómetro CCD X Calibur modelo Gemini. Los datos fueron procesados, clasificados y promediados con el software CrysAlisPro. Las estructuras de los compuestos mencionados fueron resueltas utilizando la paquetería de software SHELXTL NT.
El derivado 1 se sintetizó de acuerdo a la metodología previamente reportada (Carlson et al., 2011). Sólido amarillo. Rendimiento: 98%. P.f. 94-96°C. La estructura molecular del compuesto obtenido, comparada con la reportada previamente (Lynna et al., 2012) confirmó la obtención de 1.
Se hizo reaccionar una solución de 50 mL de tolueno seco de la cetona correspondiente con o-aminotiofenol (C6H7NS) en una relación molar 1:1.5. Posteriormente a la mezcla resultante se le agregó 1.0 g de sulfato de sodio anhidro y 2 gotas de ácido sulfúrico; esta mezcla se dejó a reflujo durante 72 horas. La mezcla de reacción obtenida se filtró a gravedad para eliminar el exceso de Na2SO4. La solución filtrada, al evaporarse, dio lugar a la formación de aceites de color amarillo que se disolvieron en CH2Cl2 y se extrajeron 5 veces con 5 mL de H2O. A la fase orgánica se le agregó carbón activado para eliminar los productos de descomposición del 2-aminotiofenol; la suspensión resultante se filtró a gravedad y se dejó en evaporación lenta, tras lo cual se obtuvieron cristales incoloros que se identificaron como los derivados 2 y 3. Ambos compuestos se obtuvieron como sólidos de color amarillo de soluciones sobresaturadas de diclorometano.
2. Rendimiento: 93%. P.f.: 115-117°C. Análisis elemental calculado para C18H14N2S: C 74.45%, H 4.86%, N 9.65. Experimental: C 74.42%, H 4.99%, N 9.89%.
3. Rendimiento: 70%. P.f.: 140-142°C. Análisis elemental calculado para C17H13N3S: C 70.08%, H 4.50%, N 14.42. Experimental: C 70.43%, H 4.14%, N 14.62%.
Los ligantes 1 – 3 fueron obtenidos como sólidos amarillos de acuerdo al esquema 1.
Los ligantes 1 – 3 se caracterizaron en estado sólido por espectroscopía de infrarrojo (IR), así como por difracción de rayos X de monocristal, mientras que en solución fueron analizados por RMN de 1H.
En la tabla 1 se muestran las frecuencias vibracionales de tensión (ν) representativas de estos compuestos. En el espectro de IR de 1 se observan dos bandas de vibración para el grupo NH, que se atribuyen a la presencia de un grupo NH libre (3340 cm-1) y a un segundo NH que se encuentra formando un enlace de hidrógeno intramolecular débil del tipo HN···N; este enlace se forma con un átomo de nitrógeno del anillo de piridina y con el átomo de hidrógeno del grupo NH del anillo hidrobenzotiazólico (Figura 1). Para 2 y 3, los grupos NH se observaron a frecuencias mayores con respecto a los grupos NH que no forman enlaces por puentes de hidrógeno. Estos grupos se mostraron en el intervalo de puentes de hidrógeno de tipo intramolecular (Kuwabara et al., 2009). La comparación de las v de los grupos NH que participan en la formación de enlaces de hidrógeno intramoleculares para 1 (3323 cm-1), 2 (3295 cm-1) y 3 (3287 cm-1) es acorde con la propuesta de que la interacción intramolecular HN···N en 1 es la más débil.
En la figura 1 se muestra la numeración utilizada para 1 – 3, mientras que en las tablas 2 y 3 se muestran los desplazamientos químicos de 1H en CDCl3 y DMSO-d6. La observación del protón del grupo NH hacia frecuencias menores en CDCl3 (δ= 6.77–4.97 ppm) con respecto a los observados en DMSO-d6 (δ = 7.84–7.12 ppm) sugiere el predominio de puentes de hidrógeno intramoleculares débiles en disolventes de baja polaridad como CDCl3 (ver figura 1), así como la formación de puentes de hidrógeno intermoleculares en disolventes polares como DMSO-d6, que pueden originarse por asociación con el disolvente. La comparación en 2 y 3 del protón del grupo NH hacia frecuencias mayores en CDCl3 (δ = 6.14 y 6.77 ppm) con respecto a 1 (δ = 4.97 ppm) se atribuye a que 1 en disolventes apolares no presenta puente de hidrógeno intramolecular. Asimismo, el análisis de la forma de la señal del protón del grupo NH para 1 (muy ancha), mientras que en 2 y 3 (ancha) confirma que, en 1, el grupo NH contiene un hidrógeno lábil que no forma puentes de hidrógeno intramoleculares en solución de CDCl3.
En los derivados 1 y 2 se obtuvieron espectros de 1H en el intervalo de 22 a 90°C en solución de DMSO-d6, para determinar la variación del desplazamiento químico (Δδ) del protón del grupo NH con respecto a la temperatura (Δδ/ΔΤ ), y establecer la naturaleza de los puentes de hidrógeno predominantes en disolventes fuertemente coordinantes. Los valores obtenidos del Δδ/ΔΤ son acordes con la existencia de puentes de hidrógeno intermoleculares (Gellman et al., 1991), tabla 3.
Los compuestos 2 y 3 se caracterizaron además por difracción de rayos X de monocristal. En las figuras 3 y 4 se muestra que ambos compuestos presentan interacciones por enlace de hidrógeno intramoleculares del tipo N···HN, las distancias obtenidas son menores a la suma de sus radios de van der Waals [ΣrvdW (H, N) = 2.75 Å], mientras que 3 presentó una interacción intramolecular adicional débil del tipo S···HC, que es ligeramente menor a la suma de sus radios de van der Waals [ΣrvdW (H, S) = 3.0 Å], tabla 4. Asimismo, en la figura 2 se muestra para efectos de comparación la estructura de 1 (Lynna et al., 2012) que al igual que 3, presenta solamente un enlace de hidrógeno intramolecular del tipo S···HC, tabla 4.
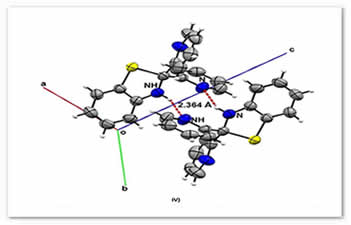
Figura 4. III) Interacciones intramoleculares N···HN y S···HC. IV) Interacciones intermoleculares N···HN en 3
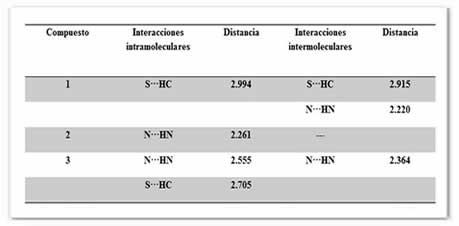
Tabla 4. Distancias de enlace (Å) seleccionadas para las interacciones por puente de hidrógeno, en los compuestos 1 – 3
El análisis de los datos obtenidos por IR y RMN de 1H muestran que en 1 la interacción intramolecular N···HN es muy débil en estado sólido, mientras que en solución esta interacción no es favorecida. Lo anterior se atribuye al mayor giro que presentan los grupos sustituyentes en 1, los cuales no permiten la formación de fuertes interacciones intramoleculares del tipo N···HN. Asimismo, se propone que en 2 y 3 el giro de los sustituyentes, al ser más restringido, da lugar a la formación de interacciones intramoleculares débiles. Lo anterior es acorde con los datos de rayos X para 2 y 3 que muestran la presencia de interacciones intramoleculares N···HN, mientras que en 1 la interacción intramolecular observada es de tipo S···HC.
JAH agradece al CONACYT por la beca otorgada Id 573330.
Carlson, L., Welvy, J., Zebrowsky, K., Wilk, M., Giroux, R., Ciancio, N.,Tanskib, J. M., Bradley, A., Tyler, L.A. (2011) Spectroscopic differences between heterocyclic benzothiazoline, -thiazole and imine containing ligands and comparison of the Co and Cu pyridine benzothiazole and imine complexes. Inorganica Chimica Acta, 365(1), 159-166.
Dannenberg, J. (2005) The importance of cooperative interactions and a solid-state paradigm to proteins: what peptide chemists can learn from molecular crystals. Advances in Protein Chemistry, 72, 227-273.
Gaumont, A., Gulea, M., Levillain, J. (2009) Overview of the chemistry of 2-thiazolines. Chemical Reviews, 109(3), 1371-1401.
Gellman, S., Dado, G., Liang, G., Adams, B. (1991) Conformation-directing effects of a single intramolecular amide-amide hydrogen bond: variable-temperature NMR and IR studies on a homologous diamide series. Journal of the American Chemical Society, 113(4), 1164-1173.
Kuwabara, J., Mori, H., Kanbara, T. (2009) Crystal structure and intramolecular hydrogen bonding of a substituted diaminoquinoxaline. Heterocycles, 78(10), 2601-2607.
Lynna, M., Carlson, L., Hwangbo, H., Tanski, J., Tyler, L. (2012) Structural influences on the oxidation of a series of 2-benzothiazoline analogs. Journal of Molecular Structure, 1011, 81-93.
Yong-Hui, T., Kertesz, M. (2009) Low-bandgap pyrazine polymers: ladder-type connectivity by intramolecular S···N(sp2) interactions and hydrogen bonds. Macromolecules, 42(7), 2309-2312.
Yuan, L., Feng, W., Yamato, K., Sanford, A., Xu, D., Guo, H., Gong B. (2004) Highly efficient, one-step macrocyclizations assisted by the folding and preorganization of precursor oligomers. Journal of the American Chemical Society, 126(36), 11120-11121.
Zhan-Ting, L., Jun-Li, H. C. (2008) Peptide mimics by linear arylamides: A structural and functional diversity test. Accounts of Chemical Research, 41(10), 1343-1353.
[a] Estudiante de Maestría en Química. Área Académica de Química (AAQ).correo-e: jaah_1988@hotmail.com
[b] Estudiante de Posdoctorado en Química. Centro Conjunto de Investigación en Química Sustentable UAEM-UNAM. correo-e: hedezbal@hotmail.com
[c] Profesor Investigador Titular. Área Académica de Química (AAQ). correo-e: gmontiel@uaeh.edu.mx; jgar@uaeh.edu.mx; nandrade@uaeh.edu.mx.