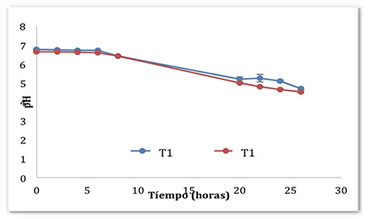
Figura 1. Cinética de fermentación del pozol en base láctea y acuosa con L. rhamnosus GG y S. thermophillus.
Igual que en simbióticos lácteos, algunos péptidos liberados durante la proteólisis de zeína presentan actividad biológica. Los estudios de proteólisis durante la fermentación de alimentos tradicionales mexicanos, como el pozol, no han sido explorados con profundidad. Así, el objetivo de este trabajo fue determinar la capacidad proteolítica de Lactobacillus rhamnosus GG y Streptococcus thermophilus durante la fermentación de maíz cacahuazintle y durante la refrigeración del fermento. Se hicieron dos fermentaciones de maíz, una con leche y otra sin leche. La proteína se ajustó 2.37 %. Las fermentaciones fueron a 37°C por 26 horas hasta un pH de 4.5. El fermento se almacenó a 4°C por 6 semanas. Las aminas primarias se midieron por la técnica de TNBS. La proteólisis aumentó a las 2 horas en la fermentación sin leche y a las 6 horas cuando la había (2.32 y de 7.29 mg/mL, respectivamente). Al final, la concentración de grupos amino libres fue de 4.4 mg/mL en la fermentación con leche y de 9.57 mg /mL cuando no la había y al final de la refrigeración la concentración fue de 5.6 mg/mL y de 8.6 mg/mL respectivamente. Finalmente, se comprobó que L. rhamnossus GG es capaz de hidrolizar la zeína.
Palabras clave: maíz, probiótico, fermentación, bacterias ácido lácticas
As in symbiotic dairy fermented food, some released peptides during proteolysis of zein exhibit biological activity. Since there are not studies of peptides produced during fermentation of traditional Mexican foods like pozol, our objective was to determine the proteolytic capacity of Lactobacillus rhamnosus GG and Streptococcus thermophilus during fermentation of cacahuazintle corn and during the refrigerated storage of the ferment. Non-milk and milk corn fermentation were studied. The amount of protein was the same in both systems (2.37%). The fermentations were carried out at 37 °C to a pH of 4.5, which was reached after 26 hours in both systems. The fermented corn was stored at 4°C for 6 weeks. Proteolysis was evaluated by the concentration of primary amines by the technique of TNBS. At the end of the fermentation, the concentration of free amino groups was 4.4 mg/mL when milk was absent and 9.57 mg/mL when there was milk in the medium. At the end of the refrigerated storage, the free amino groups concentration was 5.6 mg/mL in non-milk fermentation and 8.6 mg/mL in the second one. Finally it was found that L. rhamnossus GG is capable of hydrolyzing zein.
Keywords: corn, probiotic, fermentation, lactic acid bacteria
Durante el proceso de fermentación se liberan ácidos orgánicos (láctico, butírico y propionico) que ayudan a conservar el alimento por más tiempo; además, se liberan algunos aminoácidos que aumentan la calidad nutritiva del alimento (Wacher, 2014). Algunos de estos aminoácidos que se incrementan son la lisina y el triptófano, además de vitaminas como la niacina y la riboflavina (Barros y Buenrostro, 2011). Durante la liberación de estos aminoácidos también se liberan segmentos de proteína (péptidos), debido a su hidrólisis por proteasas pertenecientes al sistema proteolítico de los microorganismos (Villadóniga et al., 2009). Algunos péptidos liberados durante la fermentación pueden presentar actividad biológica; es decir, son capaces de regular funciones fisiológicas en el humano. La actividad biológica que presentan los péptidos es variada: actividad antihipertensiva, antioxidante, antimicrobiana, anticancerígena y antitrombótica (Chel-Guerrero y Betancur-Ancona, 2008). Debido a la actividad biológica que presentan estos péptidos, se han realizado estudios diversos para encontrar péptidos biológicamente activos en alimentos fermentados (Rojas-Ronquillo et al., 2012; Figueroa-Hernández et al., 2012; Alvarado, 2012; González-Olivares et al., 2011 y Alexaindre et al., 2008). Aunque estas investigaciones fueron centradas en la obtención de péptidos bioactivos de origen animal, los péptidos también pueden originarse de fuentes vegetales como la soya, arroz, maíz, garbanzo, amaranto, trigo sarraceno, colza y piñón mexicano (Gallegos et al., 2013).
Se ha observado que, al igual que los alimentos de base láctea fermentados con probióticos en presencia de prebióticos que presentan actividad antioxidante (Martínez et al., 2003), algunos péptidos liberados durante la proteólisis de zeína de maíz presentan esta misma actividad (Gallegos et al., 2013). Asimismo, los estudios de péptidos derivados de la hidrólisis de proteínas de origen vegetal durante la fermentación de alimentos tradicionales mexicanos, como el pozol, no han sido explorados con profundidad. Vasudha y Mishra (2013) han descrito que el pozol es una bebida refrescante consumida en el sureste de México, elaborada a base de maíz cocido en agua de cal, enjuagado, molido y formado en pequeñas bolas que se envuelven en hojas de plátano y que se dejan fermentar de 0.5 a 4 días. Durante la elaboración del pozol, los granos de maíz se sobrecuecen y forman así almidón resistente debido al fenómeno de retrogradación (Paredes-López et al., 2008). Por tal razón, al consumir pozol, el almidón retrogradado se aprovecha como fibra en el intestino. Este almidón también puede ser aprovechado por la flora microbiana de nuestro estómago y servir como prebiótico.
Debido a todo esto, el objetivo de este trabajo fue determinar la viabilidad y la capacidad proteolítica de Lactobacillus rhamnosus GG y Streptococcus thermophilus durante la fermentación de maíz cacahuazintle.
El experimento se llevó a cabo en tres fases; la primera fase consistió en montar los sistemas de fermentación, la segunda implicó estudiar la cinética de fermentación y durante la tercera se almacenó el producto en refrigeración. Se utilizó maíz de la variedad cacahuazintle, adquirido en la central de abasto de la ciudad de Pachuca, Hidalgo.
Se trabajó con dos sistemas de fermentación, uno sin leche (T1) y otro con leche (T2), cada uno por duplicado; ambos sistemas contenían la misma cantidad de proteína (2.37% p/v), para lo cual se determinó el contenido de proteínas en el pozol por el método Kjeldhal. Para preparar el pozol se nixtamalizaron los granos de maíz (con cal al 1%), y seguidamente se enjuagó el nixtamal con la finalidad de eliminar el exceso de cal hasta que el agua de enjuague tuviera un pH de 7; por último, los granos se volvieron a someter a ebullición con agua destilada hasta que el grano adquirió el doble de su tamaño original, se drenó el agua y los granos se molieron en un molino manual. Para el sistema T1 se utilizaron 40 g de masa de pozol esterilizado, que se diluyeron en agua estéril hasta obtener un volumen final de 190 mL. Para el sistema T2 se utilizaron 20 g de masa estéril a la que se le añadieron 1.48 g de leche Gold Dairy (32% de proteína, para igualar el contenido de proteína de ambos sistemas) que posteriormente se diluyeron con agua estéril hasta un volumen total de 190 mL. Los sistemas se pasteurizaron a 90°C por 15 minutos; luego, se inocularon con 106 UFC/mL de Lactobacillus rhamnosus GG y Streptococcus thermophilus. Ambas son cepas axénicas obtenidas del Laboratorio de Biotecnología Alimentaria de la Universidad Autónoma Metropolitana unidad Iztapalapa.
La cinética de fermentación se estudió por incubación de los sistemas a 37°C. La fermentación se detuvo cuando los sistemas alcanzaron un pH de 4.5. Este valor de pH asegura que no hay inhibición del microorganismo por presencia de ácido láctico. Los parámetros que se midieron durante la fermentación fueron pH y la presencia de grupos amino libres. En el transcurso de la fermentación se tomaron muestras (5 mL) cada dos horas. A estas muestras se le midió pH; luego se centrifugaron a 10,000 rpm a 4°C por 10 minutos en una centrífuga Eppendorf con el fin de separar la biomasa de las proteínas de alto peso molecular presentes en el sobrenadante. Este se guardó en congelación a -14°C para la posterior medición de los grupos amino libre. El análisis de la concentración de grupos aminos libres se realizó por medio del método del ácido trinitrobencilsulfónico (TNBS), reactivo que reacciona específicamente con grupos amino primarios para formar un compuesto cromóforo con un máximo de absorbancia a 340 nm (Spellman et al., 2003). La cantidad de grupos amino libres se expresó en mg de glicina/mL, por extrapolación de la curva de calibración (0.05, 0.1, 0.15, 0.2 y 0.25 mg glicina/mL).
Después de terminar el proceso de fermentación, los sistemas se almacenaron a 4°C durante seis semanas. Se tomaron muestras de 5 mL a las 3, 4, 5 y 6 semanas. Las muestras se centrifugaron a 10,000 rpm a 4oC por 10 minutos. Se realizaron análisis de viabilidad y de proteólisis. La viabilidad se determinó por el método de conteo en placa en medio MRS a un pH de 4.5 (que se alcanzó por adición de una solución de ácido cítrico 1M). Por último, la proteólisis se siguió con el método de TNBS.
La reducción del pH en los dos sistemas (Figura 1) indica que alguno de los dos microorganismos usados en la fermentación (L. rhamnosus GG y S. thermophilus) presenta actividad amilolitica, con lo cual el almidón se convierte a glucosa y luego a maltosa (Wacher, 2014). Algunas especies del género Streptococcus, como S. macedonicus aislado del pozol, presentan actividad amilolítica (Díaz-Ruiz et al., 2003). El tiempo necesario para alcanzar un pH cercano a 4.5 fue de 26 horas para ambos sistemas; el sistema que más se acercó a dicho pH fue el T2 que contenía leche (pH de 4.5 ± 0.005). La adición de leche al sistema de fermentación del pozol es capaz de aumentar el nivel de acidez del fermento final y por ende habrá una disminución del pH. Casanova et al. (2003) reportan que la dilución de la masa del pozol en leche durante la fermentación con 10% de cultivos de yogurt es capaz de generar una acidez de 0.744 % a las 48 horas de fermentación.

Figura 1. Cinética de fermentación del pozol en base láctea y acuosa con L. rhamnosus GG y S. thermophillus.
Durante la fermentación del pozol, la parte proteica de la masa queda expuesta al ataque proteolítico de los microorganismos. Esto se debe a que la proteína dentro del maíz, en especial la parte del endospermo, se encuentra en forma de unas láminas protegidas por partículas esféricas de almidón (Benítez y Pfeiffer, 2006). El endospermo aún se mantiene en la masa del pozol, ya que el proceso de molienda no es tan fino como el que se utiliza para la obtención de masa. La proteólisis se puede comprobar por la formación de grupos amino libre en los dos sistemas. En la Figura 2 se puede observar que durante las primeras dos y seis horas existe un aumento de los grupos amino libres en el T1 y el T2 de 2.32 ± 0.88 y 7.29 ± 0.29 mg glicina/mL, respectivamente. Sin embargo, esta relación cambia drásticamente tras 20 horas de fermentación, ya que en T1 aumenta el contenido de grupos amino libres a 4.47 ± 0.2 y en el T2 disminuye hasta 2.38 ± 1.45 mg de glicina/mL. Este comportamiento se observa durante toda la fermentación, y se debe a la acción simbiótica de los microorganismos utilizados. Durante las primeras horas de la fermentación, Lactobacillus rhamnosus GG se encarga de cortar las proteínas, tanto del pozol como la leche, razón por la cual se observa un incremento en los grupos amino libres. En las horas siguientes entra en acción Streptococcus thermophilus, bacteria que requiere grupos amino libres para su crecimiento (Rojas, 2009). Por esta razón se presentan aumentos y disminuciones de grupos amino libres en la fermentación. Al final de esta, la cantidad de grupos amino libres fue de 4.4 mg de glicina/mL para el sistema T1 y 9.57 mg de glicina/mL para el sistema T2.
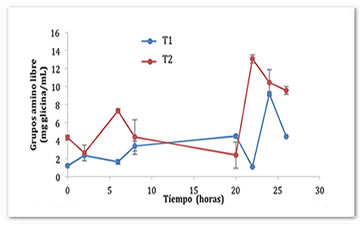
Figura 2. Generación de grupos amino libre durante la fermentación del pozol en base láctea y acuosa con L. rhamnosus GGy S. thermophilus.
Durante el almacenamiento en refrigeración (Figura 3), en el sistema T2 disminuyó la cantidad de grupos amino libres hasta 8.6 mg de glicina/mL, mientras que en el sistema T1 aumentó hasta 5.2 mg de glicina/mL a la semana seis. De esta manera, se encontró el mismo patrón de comportamiento que durante la fermentación. La formación de grupos amino libres por proteólisis se da por acción de enzimas (proteasas) que siguen funcionando independientemente de la viabilidad de los microorganismos. Esto se pudo comprobar debido a que, a partir de la cuarta semana de refrigeración, el número de microorganismos en los dos sistemas se redujo (Figura 4). En el T1 la cantidad se redujo de 8.69 Log UFC (5 x 108 UFC/mL) en la tercera semana a 4. 47 Log UFC (3 x 104 UFC/mL) en la cuarta semana. La mayor reducción se dio en el sistema T2, de 9.1 Log UFC (1.3 x 109 UFC/mL) en la semana 3 hasta no presentar conteo a partir de la semana 4.
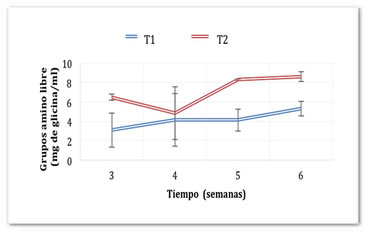
Figura 3. Generación de grupos amino libres durante la refrigeración del pozol en base láctea y acuosa fermentado con L. rhamnosus y S. thermophilus.
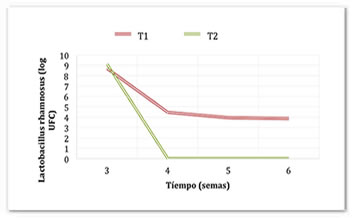
Figura 4. Viabilidad de L. rhamnosus durante el almacenamiento en refrigeración de pozol en base láctea y acuosa.
Los microorganismos usados en este trabajo fueron capaces de usar el almidón como fuente de carbono. La proteólisis se comprobó por el análisis de grupos amino libre. Esta proteólisis podría generar péptidos con actividad antioxidante proveniente de la zeína del maíz. Por otra parte, el probiótico Lactobacillus rhamnosus GG se mantiene viable durante tres semanas después de la fermentación en el sistema T1, a una concentración 5 x a108 UFC/mL. La adición de leche al sistema no ayuda a mantener vivos a los microorganismos. Por consiguiente, se sugiere la posibilidad de elaborar una bebida antioxidante a base de pozol fermentado.
Aleixandre, A., Miguel M., Muerguerza, B. (2008) Péptidos antihipertensivos derivados de proteínas de leche y huevo. Nutrición Hospitalaria, 23(4), 313-318.
Alvarado, C. C. A. (2012) Aislamiento y aplicación de péptidos bioactivos del lactosuero en un yogurt funcional. Tesis doctoral, Universidad Simón Bolívar.
Barros, C., Buenrostro, M. (2011) Pozol, popo, champurrado. Revista Digital Universitaria, 12(4), 1-9.
Benítez, C. C. G., Pfeiffer, P. H. (2006) El maíz: origen, composición química y morfología. Materiales avanzados, 7(1), 15-20.
Casanova, O. J. S., Yah, N. P. N., Bacab, C. R., Briceño, D. D. R, Cruz S. I. (2013) Elaboración de una bebida fermentada tipo yogurt a base de maíz (pozol). Innovación para la Vinculación FOMIX-Quintana Roo, 6(1), 51-58.
Chel-Guerrero, L., Betancur-Ancona, D. (2008) Biopéptidos alimenticios: Nuevos promotores de la salud. Revista Salud Pública y Nutrición, 9(2), 1-8.
Díaz-Ruiz, G., Guyot, J.P., Ruiz-Terán, F., Morlon-Guyot, J., Wacher, C. (2003) Microbial and Physiological Characterization of Weakly Amylolytic but Fast-Growing Lactic Acid Bacteria: a Functional Role in Supporting Microbial Diversity in Pozol, a Mexican Fermented Maize Beverage. Applied and Environmental Microbiology, 69(8), 4367-4374.
Figueroa-Hernández, C., Cruz-Guerrero, A., Rodríguez-Serrano, G., Gómez-Ruiz, L., García-Garibay, M, Jiménez-Guzmán, J. (2012) Producción de péptidos fijadores de calcio y hierro por Lactococcus lactis subsp. cremoris NCFB 712. Revista Mexicana de Ingeniería Química, 11(2), 259-267.
Gallegos, T. S., Chel, G. L., Corzo, R. L. J., Martínez, A. A. L. (2013) Péptidos con actividad antioxidante de proteínas vegetales. En: Bioactividad de péptidos derivados de proteínas alimentarias. OmniaScience, Barcelona, pp. 111-122.
González-Olivares, L.G., Jiménez-Guzmán, J., Cruz-Guerrero, A., Rodríguez-Serrano, G., Gómez-Ruiz, L., García-Garibay, M. (2011) Liberación de péptidos bioactivos por bacterias lácticas en leches fermentadas comerciales. Revista Mexicana de Ingeniería Química, 10(9), 179-188.
Martínez A. J. R., Muñoz, C., Urrialde, R., Fontecha, J., Murcia T. M. A., Gómez, C. C, Villarino, M. A. (2003) Nuevos alimentos para nuevas necesidades. Nueva imprenta, España.
Paredes-López, O., Guevara-Lara, F. y Bello-Pérez, L.A. (2008) La nixtamalización y el valor nutritivo del maíz. Ciencias, 60-70.
Rojas R. M. R. (2009) Perfil de péptidos bioactivos durante la fermentación de leche por Lactobacillus casei y Streptococcus thermophilus. Tesis de maestría, Universidad Autónoma Metropolitana unidad Iztapalapa.
Rojas R. M. R. (2012) Péptidos bioactivos de suero de leche y caseínas liberados por la actividad proteolítica de Lactobacillus casei Shirota y Streptococcus thermophilus. Tesis de doctorado, Universidad Autónoma Metropolitana unidad Iztapalapa.
Ruiz-Ruiz, J., Segura-Campos, M., Betancur-Ancona, D., Chel-Guerrero, L. (2013) Proteínas y péptidos biológicamente activos con potencial nutracéutico. En: Bioactividad de péptidos derivados de proteínas alimentarias. OmniaScience, Barcelona, pp. 11-27.
Spellman, D., McEvoy, E., O’cuinn, G., FitzGerald, R. J. (2003) Proteinase and exopeptidase hydrolysis of whey protein: Comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis. International Dairy Journal, 13(6), 447-453.
Vasudha, S. y Mishra, H. N. (2013) Non dairy probiotic beverages. International Food Research Journal, 20(1), 7-15.
Villadóniga, C., Vairo C. S. E., Morcelle del Valle, S. R., Errasti, M. A., Bruno, M. A., Barros, M. y Cantera, A. M. B. (2009) Productos bioactivos obtenidos por proteólisis (nutracéuticos y alimentos funcionales). En: Enzimas proteolíticas de vegetales superiores: Aplicaciones industriales. CYTED, Buenos Aires, pp. 273-297.
Wacher R. C. (2014) La biotecnología alimentaria antigua: los alimentos fermentados. Revista Digital Universitaria, 15(8), 1-14.
[a] Alumno de la Licenciatura en Ingeniería en Industrias Alimentarias del Instituto Tecnológico Superior de Felipe Carrillo Puerto
[b] Profesor Investigador de Tiempo Completo del Área Académica de Química. Ingeniero en Alimentos, Maestría y Doctorado en Biotecnología, egresado de la UAM-I egresada de la UNAM. Sus líneas de investigación son las fermentaciones lácticas y la enzimología aplicada a sistema proteolítico de bacterias lácticas. lggonzalez@uaeh.edu.mx