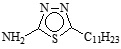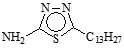Influencia de la longitud de la cadena alquílica del compuesto 2-amino-5-alquil-1,2,4-tiadiazol en la inhibición de la corrosión de acero API 5L X52 inmerso en una solución de ácido sulfúrico 1M
Miguel Ángel Abreu Quijano[a],Martin Ortiz Domínguez[a],Cristopher Gregorio Rosales Xicoténcatl[b],Viviano Olvera Torres[b]
Resumen
Para determinar la influencia de la cadena alquílica descrita en el siguiente orden: 2-etilo, 3-n-propil-, 5-n-pentil, 7-heptil, 11-undecil y 13-tridecil respecto al número de átomos de carbón de los compuestos derivados del 2-amino-5-alquil-1,3,4-tiadiazol, denominados de la siguiente manera: IC-2, IC-3, IC-5, IC-7, IC-11 e IC-13 respectivamente. Los inhibidores de la corrosión se evaluaron mediante la técnica de impedancia electroquímica espectroscópica (EIS), en un sistema de acero sumergido en ácido sulfúrico, como resultado se encontró que la eficiencia de inhibición a la corrosión, denominada IE, varía con respecto de la concentración, es decir, al incrementar la cantidad del inhibidor, la eficiencia aumenta de igual manera a excepción del compuesto IC-2 donde la IE disminuía al aumentar la concentración del inhibidor. La IE de la molécula 2-amino-5-undecil-1,3,4-tiadiazol (IC-11) alcanzó un valor máximo de 90% a una concentración de 30 ppm y al incrementar la concentración a 100 ppm, el valor de la eficiencia aumenta alrededor del 95%.
Palabras clave: Acero, H2SO4, Tiadiazoles, EIS, inhibición en ácidos
Abstract
To determine the influence of the alkyl chain described in the following order: 2-ethyl, 3-n-propyl-, 5-n-pentyl, 7-heptyl, 11-undecyl and 13-tridecyl on the number of carbon atoms the compounds derived from 2-amino-5-alkyl-1,3,4-thiadiazole, denominated as follows: IC-2, IC-3, IC-5, IC-7, IC-11 and IC-13 respectively. The corrosion inhibitors were evaluated using the technique of Electrochemical Impedance Spectroscopic (EIS), in a steel system immersed in sulfuric acid, as a result it was found that the efficiency of corrosion inhibition, called IE, varies with respect to the concentration, that is, by increasing the amount of inhibitor efficiency increases similarly except the compound IC-2 where the IE decreased with increasing concentration of inhibitor. The IE of molecule of 2-amino-5-undecyl-1,3,4-thiadiazole (IC-11) reached a maximum of 90% at a concentration of 30 ppm and increasing the concentration to 100 ppm, the value of efficiency increases about 95%.
Keywords: Steel, H2SO4, Thiadiazoles, EIS, acid inhibition
Introducción
Cuantos más datos e información se tiene sobre la cinética y mecanismos de la corrosión que existen en los ductos que transportan el petróleo, se puede observar que el mayor control y predicción de los daños a la infraestructura, a la economía y para la salud humana causados por la degradación del acero, son originados en la operación de rutina y se combaten con el uso de inhibidores de la corrosión, ya que su costo es relativamente bajo, de acuerdo a los beneficios. Esto constituye un objetivo verdaderamente deseable para los operadores. Sería tentador decir que cuando la tubería de acero en las superficies interiores está expuesta, durante las operaciones de producción en ambientes químicamente complejos, el procedimiento de las condiciones agresivas, corrosivas se facilita. Esto es aparentemente cierto, como la posibilidad de generar serias condiciones que dan lugar a las películas superficiales consolidadas que desaceleran el desgaste electroquímico, incluso bajo los regímenes con un rango amplio de variaciones hidrodinámicas, no en flujo turbulento[1]. En este sentido, se ha demostrado que las diferentes moléculas orgánicas heterocíclicas [2][5] y compuestos anfifílicos [6][7], han sido probados como inhibidores y de acuerdo a sus características y propiedades que tienen, inhiben la corrosión de la tubería de acero grado API 5L X52 inmersos en medios agresivos tales como H2SO4 y HCl. Sin embargo, la influencia de la longitud de la cadena alquílica del compuesto 2-amino-5-alquil-1,3,4-tiadiazol tiene la capacidad de inhibición de la corrosión del acero inmerso en ácido sulfúrico y, en particular, la cinética de este proceso de inhibición de la corrosión no ha sido analizada.
Desarrollo experimental
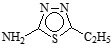
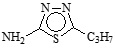
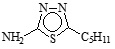
En la Tabla 1 se puede observar la estructura de los compuestos que se utilizaron como inhibidores de la corrosión en un sistema de acero API 5L X52 inmerso en H2SO4 1M.
Inhibidor |
Estructura |
Nombre |
| IC-2 |
|
2-Amino-5-etil-1,3,4-tiadiazol |
| IC-3 |
|
2-Amino-5-n-propil-1,3,4-tiadiazol |
| IC-5 |
|
2-Amino-5-n-pentil-1,3,4-tiadiazol |
| IC-7 |
|
2-Amino-5-heptil-1,3,4-tiadiazol |
| IC-11 |
|
2-Amino-5-undecil-1,3,4-tiadiazol |
| IC-13 |
|
2-Amino-5-tridecil-1,3,4-tiadiazol |
Tabla 1. Nombre, estructura y denominación de los compuestos orgánicos utilizados como inhibidores de la corrosión.
La eficiencia de inhibición (IE) de algunos derivados de los tiadiazoles, como los inhibidores de la corrosión de aceros al carbono inmersos en H2SO4 1M fue determinada por Espectroscopía de Impedancia Electroquímica (EIS). En este trabajo se utilizaron seis moléculas de compuestos orgánicos tales como, 2-amino-5-etil-1,3,4-tiadiazol (CI-2), 2-amino-5-n-propil-1,3,4 tiadiazol (IC -3), 2-amino-5-n-pentil-1,3,4-tiadiazol (IC-5), 2-amino-5-heptil-1,3,4-tiadiazol (IC-7), 2-amino-5-undecilo-1,3,4-tiadiazol (IC-11) y 2-amino-5-1-tridecil,3,4-tiadiazol (IC-13) con 2, 3, 5, 7, 11 y 13 átomos de carbono en la cadena de alquilo, respectivamente. Todos los compuestos se disolvieron en disoluciones de etanol-agua 1:1, para obtener una solución 0.01M. A partir de esta solución, se prepararon diferentes concentraciones, entre 5 y 100 ppm, en un electrolito soporte de H2SO4 1M. Este rango de concentración fue elegido basado en estudios anteriores [2][3]. La solución en ausencia de los inhibidores se tomó como blanco para realizar una comparación.
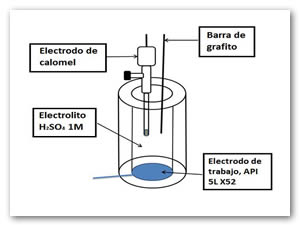
Se utilizó una celda electroquímica convencional con tres electrodos. El electrodo de trabajo fue preparado a partir de acero API 5L X52 de tubería expuesta, el electrodo de referencia fue de Calomel saturado y como contraelectrodo una barra de grafito. El electrodo de trabajo se aseguró que tuviera transferencia eléctrica, dejando aproximadamente 1 cm2 de la superficie expuesta al electrolito corrosivo. Antes de cada corrida experimental, la superficie del electrodo se preparó de la siguiente manera: las muestras se pulieron mecánicamente con papel abrasivo de carburo de silicio de diferentes tamaños hasta 1,200 grados, a continuación, los electrodos fueron limpiados por ultrasonido con etanol durante 10 minutos y finalmente se seca en un flujo de aire seco. Los datos electroquímicos fueron adquiridos en relación con el electrodo de calomel saturado (SCE), y una barra de grafito que sirve como contra-electrodo.
Figura 1. Celda electroquímica de tres electrodos.
El electrodo de trabajo se sumerge en el electrolito de prueba durante 15 minutos para medir el potencial de un estado de equilibrio del circuito abierto (Eocp). Las mediciones de impedancia electroquímica EIS, se llevaron a cabo en circuito abierto en condiciones del laboratorio, con la estación de trabajo Zahner IM6, con una señal pequeña de perturbación sinusoidal de ± 10 mV en torno al Ecorr. El rango de frecuencia empleado fue de 106 a 10-2 Hz con 10 puntos por década. Los datos de impedancia obtenidos experimentalmente a través de este trabajo se representan mediante los diagramas de Nyquist. La resistencia de transferencia de carga Rct y la capacitancia de la doble capa (Cdl), dichos valores, se calcularon mediante el ajuste de los puntos de datos experimentales en los diagramas de Nyquist para obtener un adecuado circuito eléctrico equivalente (CEE).
Resultados
Los datos de la corrosión de tuberías de acero al carbono expuestos a una solución de H2SO4 1M con diferentes concentraciones de los inhibidores derivados de los tiadiazoles CI-2, IC-3, IC-5, IC-7, IC-11 e IC13 fue obtenido por EIS a temperatura ambiente y se observa en la Figura 2, la respuesta sin inhibidores de la corrosión (es decir en blanco) también se indica, para así tener un comparativo de los experimentos. Como puede verse en la Figura 2a-2f, los diagramas de Nyquist para todos los compuestos muestran una depresión en forma de semicírculo, con el centro por debajo del eje x real. El diámetro de estos semicírculos está directamente asociado con la resistencia a la transferencia de carga (Rct) y con la carga eléctrica de la doble capa (Cdl), lo anterior ocurre en la interface de la superficie del acero y el electrolito, el diámetro se incrementa con el aumento de la concentración de la mayoría de los compuestos excepto con el compuesto 2-Amino-5-etil-1,3,4-tiadiazol (IC-2). Sin embargo, existe una disminución en el diámetro del semicírculo de (Z' real) a medida que aumenta la concentración del inhibidor, esto sólo se observó para el compuesto con la cadena de carbono más corta, el inhibidor IC-2 que se muestra en la Figura 2a. Por lo tanto, el semicírculo más pronunciado con una magnitud de alrededor de 475 Ω-cm2 (Z' real) se observó después de la adición de 100 ppm del inhibidor de cadena de 11 carbonos, es decir, el IC-11, que contiene 11 átomos de carbono en su grupo alquilo de cadena y una impedancia menor de 50 Ω-cm2 para el inhibidor de la cadena más corta de carbonos, el IC-2 y aproximadamente de 130 W-cm2 para el inhibidor de la cadena más larga IC-13, con la misma concentración, en comparación con el acero sin inhibidor (Z' real no es más de 25 Ω-cm2) . Por lo tanto, el valor máximo alcanzado de Z' real es con el compuesto IC-11 a 100 ppm, de acuerdo a los resultados se tiene una idea general de la capacidad de inhibición de la corrosión sobre el acero expuesto a la solución acuosa de ácido sulfúrico.

Figura 2. Diagrama de Nyquist del acero API 5L X52 inmerso en H2SO4 1M en presencia de diferentes concentraciones de compuestos de la familia de los tiadiazoles: a) IC-2, b) IC-3, c) IC-5, d) IC-7, e) IC-11 y f) IC-13.
Se decidió utilizar el circuito eléctrico equivalente (CEE) más simple para ajustarse al comportamiento de la impedancia para el blanco (Figura 3”A”). Este CEE consiste en la combinación en paralelo de resistencias, Rct y su elemento de fase constante (CPE) en lugar del condensador de doble capa, debido a la rugosidad y porosidad entre otras irregularidades de la superficie del electrodo, se conectan en serie con la resistencia Rs considerando que, para 100 ppm de concentración del inhibidor IC-11 el CEE se utiliza para describir adecuadamente el comportamiento de la impedancia por EIS y se muestra en la Figura 3“B”. Este CEE tiene dos bucles capacitivos y está compuesto por dos elementos de fase constante (CPE) con sus respectivas resistencias, Rmol (resistencia del recubrimiento de las moléculas orgánicas) y Rct (resistencia a la transferencia de carga), conectados en paralelo y su resistencia a la solución (Rs) que está conectada en serie, el arreglo anterior da origen al circuito equivalente y se debe a la presencia de dos interfaces, el sistema de H2SO4 más el recubrimiento o la interface inhibidor-metal. En este caso Rmol está asociada con la resistencia del inhibidor adsorbido sobre la superficie metálica.

Figura 3. El circuito eléctrico equivalente utilizado. El circuito “A” es el blanco y el circuito “B” fue utilizado con el inhibidor IC-11, con una concentración mayor a 20 ppm.
La eficiencia (IE) para inhibir la corrosión se calcula mediante la siguiente ecuación:
Donde Rct(inh) y Rct(blanco) son los valores de resistencia a la transferencia de carga con y sin inhibidor, respectivamente. Rct puede ser interpretado como un término eléctrico que es inversamente proporcional a la velocidad de corrosión.
El valor de la eficiencia a la inhibición de estos compuestos se obtuvo a través de la técnica EIS y utilizando la ecuación (1), el comportamiento de la eficiencia se muestra en la Figura 4, claramente se puede observar que la eficiencia varía con respecto a la concentración de la siguiente manera: a medida que la concentración del inhibidor aumenta su eficiencia de inhibición también aumenta, a excepción del inhibidor IC-2, que disminuye. Para una concentración de los inhibidores de 50 ppm, la eficiencia a la inhibición está clasificada de la siguiente manera: IC-2 < IC-3 < IC-13 < IC-5 < IC-7 < IC-11 por lo tanto, en términos de capacidad de inhibición de estos compuestos, el número óptimo de átomos de carbono en la cadena alquílica es de 11. La eficiencia a la inhibición de la molécula 2-amino-5-undecil-1,3,4-tiadiazol (IC-11) alcanza un valor del 90% a 30 ppm y 95% a 100 ppm. En base a estos resultados, se decidió elegir 100 ppm como la concentración del inhibidor óptima, para fines comparativos entre los diferentes compuestos orgánicos.

Figura 4. Variación de la eficiencia de inhibición de los compuestos IC-2, IC-3, IC-5, IC-7, IC-11 e IC-13 derivados de los tiadiazoles en función de su concentración.
Conclusiones
De los inhibidores que se evaluaron en el presente trabajo, el que resultó tener una mejor eficiencia para inhibir la corrosión en un sistema de acero API 5L X52 inmerso en H2SO4 1M, fue el denominado IC-11 (2-Amino-5-undecil-1,3,4-tiadiazol), el cual tiene un valor de IE de 98% a una concentración de 100 ppm, el circuito eléctrico equivalente adecuado al máximo valor de eficiencia es el mostrado en la figura 3”B”.
Agradecimientos
Los autores del presente trabajo le agradecen al Ing. Martín Ortiz Granillo, quien es Director de la Escuela Superior de Ciudad Sahagún-UAEH, México, por las facilidades otorgadas para la realización de este trabajo de investigación.
Referencias
[1] L. Rodríguez-Bravo, M. Romero-Romo, C. Ángeles-Chávez, M. Palomar-Pardavé Chapter 9 in Electrochemistry and Materials Engineering, (2007) Research Signpost. Editors: Manuel Palomar-Pardavé and Mario Romero-Romo.
[2] P. Morales-Gil, G. Negrón-Silva, M. Romero-Romo, C. Ángeles-Chávez, M. Palomar-Pardavé, Electrochim. Acta 49 (2004) 4733.
[3] R. Álvarez-Bustamante, G. Negrón-Silva, M. Abreu-Quijano, H. Herrera-Hernández, M. Romero-Romo, A. Cuán, M. Palomar-Pardavé. Electrochim. Acta, 54, (2009) 539.
[4] A. Espinoza V, G. Negrón, M. E. Palomar-Pardavé M. A. Romero-Romo, I. Rodríguez, H. Herrera-Hernández, ECS Transactions, 20 (1) (2009) 543.
[5] D. Y. Cruz, G. Negrón, M. A. Romero-Romo, H. Herrera-Hernández, M. E. Palomar-Pardavé, ECS Transactions, 20 (1) (2009) 519.
[6] M. Palomar-Pardavé, C.O. Olivares-Xometl, N.V. Likhanova, J.B. Pérez-Navarrete, J. Surfact. Deterg., 14 (2011) 211.
[7] J.B. Pérez-Navarrete, C.O. Olivares-Xometl, N.V. Likhanova, J. Appl. Electrochem. 40 (2010) 1605.
[a] Profesor Investigador del Plan Educativo de Licenciatura en Ingeniería Mecánica de la Escuela Superior de Ciudad Sahagún de la Universidad Autónoma del Estado de Hidalgo.
[b] Estudiante del Plan Educativo de Licenciatura en Ingeniería Mecánica de la Escuela Superior de Ciudad Sahagún de la Universidad Autónoma del Estado de Hidalgo.