Síntesis de Óxido de Cobalto y Óxido de Hierro
Resumen
En este trabajo, a través del método de precipitación convencional fueron sintetizados óxido de cobalto y óxido de hierro con hidróxido de amonio como agente precipitante. El efecto del solvente (agua y alcohol etílico) y la calcinación del óxido de cobalto y óxido de hierro en modo vibración fueron analizados. Todos los polvos obtenidos fueron calcinados a 500 °C por 2 horas para eliminar residuos y fueron analizados utilizando Raman. El análisis de Raman confirma que para los polvos de óxido de cobalto y hierro que fueron sintetizados utilizando como solvente el etanol muestra que existe mayor cristianización la cual es conveniente por la presencia de iones de - OH. También en el análisis Raman confirma que la calcinación es un profeso obligatorio para convertir material amorfo en fase cristalina. Todos los polvos obtenidos en este trabajo pueden ser utilizados como material de censado para la detección de hidrocarburos.
Palabras clave: cobalto, hierro, oxido, precipitación, Raman
Abstract
In this work, Cobalt oxide and iron oxide nanoparticles were synthesized utilizing conventional precipitation with ammonium hydroxide as precipitation agent. The effect of solvent (water and ethanol) and calcination on both cobalt and iron oxide vibrational modes were analyzed. All the obtained powders were calcined for eliminating the residuals at 500 0C for 2 h and were analyzed utilizing Raman characterization. Raman analysis confirms that for both cobalt and iron oxide powders synthesized utilizing ethanol as solvent shows higher crystallinity which is due to the presence of OH- ions. Also Raman analysis confirms that the calcination is a compulsory process to convert amorphous to crystalline phase. All the powders obtained in this work can be utilized as sensing material for detecting hydrocarbons.
Keywords: cobalt, iron, oxide, precipitation, Raman
1. Introducción
El óxido de cobalto, es utilizado en la industria petrolera y petroquímica como tratamiento de materias primas y productos terminados. En la fabricación de semiconductores se utiliza para los componentes del circuito tales como resistencias. En los productos alimenticios se utiliza para aumentar el contenido nutricional, debido a que ayuda al crecimiento y desarrollo reproductivo entre los animales debido a que toma una forma parecida a la vitamina B12. El óxido de cobalto se utiliza para dar color azul al vidrio, porcelana y azulejos vidriados y le da un tinte azul al esmalte de acero. Es también un agente de secado de aceite, pinturas y tintas, y se usa en tintas agradables, incoloros e invisibles hasta que son expuestos a los productos químicos, el calor o la luz.
El óxido de hierro tiene color rojo vivo que tiene utilidad como pigmento, para ser utilizados en diversas clases de pinturas y es común en diversas aplicaciones relativas a la estética, como por ejemplo la cosmética, barnices o incluso en tatuajes. Por otro lado, el óxido férrico puede funcionar como un aislante eléctrico, para el tratamiento de aguas residuales o para la elaboración de cristales semiconductores en conjunción con otros elementos.
Algunos métodos utilizados para la obtención del óxido de cobalto (se puede extraer de minas de manera natural) y de hierro son método eléctrico de análisis, método de análisis cromatógrafo, método de co-precipitación. El método de precipitación convencional fue utilizado ya que es uno de los más comunes, además de ser practico, económico y se obtienen resultados precisos, en un tiempo mínimo.
En la tabla 1 se pueden apreciar algunos antecedentes de trabajos de óxido de cobalto y óxido de hierro (empleados como sensores de gas), en los cuales nos basamos para realizar nuestra síntesis de óxido de cobalto y óxido de hierro, obteniendo algunos polvos.
En la actualidad la contaminación atmosférica genera problemas ambientales lo cual causa efectos negativos en la población, por ejemplo, el desarrollo de enfermedades, este factor fue el principal motivador para realizar la investigación previa y llevar a cabo la síntesis correspondiente.
Los polvos obtenidos se encuentran en la primera etapa, ya que en un futuro se pretende utilizarlos en sensores de gas; el óxido de cobalto detectará CO2, mientras que el óxido de hierro servirá para detectar diabetes.
Tabla 1 Antecedentes de trabajos de óxido de cobalto y óxido de hierro
| Precursores | Método | Propiedades | Resultados |
| Los nano cristales de Co3O4 encapsulados con óxido de grafeno reducido (rGO). | Se fabricaron utilizando la tecnología de electrohilado. | Se muestra la morfología de nano fibras y los nano cristales de Co3O4 fueron envueltos por capas delgadas rGO. | El sensor muestra selectividad a varios interferentes potenciales como metanol, etanol, formaldehído, acetona, benceno y metilbenceno. Se puede atribuir a la exclusiva microestructura de envoltura jerárquica y a la adsorción selectiva de NH3 tanto en la capa de envoltura de rGO como en los centros covalentes CCo3 + polarizados dentro de las nanofibras. |
| Las nanopartículas de Co1-xNixFe2O4 -Los elementos Co, Ni, Fe y O |
Método de coprecipitación química húmeda. | El mapeo con Rayos Dispersivos de Energía (EDX) confirma la distribución homogénea de los elementos Co, Ni, Fe y O en las ferritas. | Se encuentra que la adición de iones Ni2 + en ferrita de cobalto muestra una selectividad preferida hacia el gas CO a alta temperatura (325 ° C) y etanol a baja temperatura (250 ° C), |
| Nanopartículas de Co3O4 | Se desarrolla un método de descarga de arco para fabricar nanopartículas de Co3O4 y estructuras nanocompuestas de nanotubos de carbono de pared simple (SWCNT) Co3O4. | La inserción de contenido de Co variable en el tubo de grafito produjo proporcionalmente diferentes composiciones de nanopartículas de Co en la banda de SWCNT sintetizadas. La temperatura de oxidación empleada determina el contenido de SWCNT que permanece en los compuestos, así como la cristalinidad de las nanopartículas de óxido de cobalto. | En general, las películas hechas de aglomeraciones de nanopartículas mostraron un mejor rendimiento que los sensores de tipo de película delgada, lo que ilustra el efecto nano. |
| Co / ZnO | Método hidrotermal. | Las microestructuras de ZnO dopado puro y con cobalto se han preparado por método hidrotermal y calcinaciones a 600 ° C. La estructura cristalina, la morfología de la superficie y la composición química de las muestras se determinaron mediante difracción de rayos X, microscopía electrónica de barrido y espectroscopía fotoelectrónica de rayos X, respectivamente, lo que indica que la presencia de una pequeña cantidad de iones Co puede afectar en gran medida la morfología del Nanoestructuras de ZnO. | Cuando se usó para la detección de gas metano, el sensor de 1% en peso de Co / ZnO (CZ1) mostró la respuesta más alta a 100 ppm de metano a 140ºC, que era aproximadamente 2 veces mayor que la de las muestras de ZnO puro. Además, el sensor de 1% en peso de Co / ZnO también mostró un tiempo de respuesta / recuperación rápido (19/27 s), límite de detección bajo (50 ppb). Por lo tanto, las microestructuras CZ1 son prometedoras para aplicaciones prácticas de detección de metano. |
| Nanoparticulas de O, puros y dopados con Ag |
Método de co-precipitación | Se usó alúmina como material soporte de los sensores y formvar (poliviniloformal) como material ligante. |
Los difractogramas XRD revelaron la presencia mayoritaria de la fase! -hematita en todos los sensores. El tamaño promedio de las nanopartículas, determinado mediante micrografías TEM, estuvo entre 30 y 50 nm con presencia de aglomeraciones de diversos tamaños. Las isotermas BET mostraron que los sensores presentaban una superficie mesoporosa con un área promedio entre 66 y 88 m /g. |
| limonita (FeO[OH].nH O) | mediante el análisis térmico a temperaturas, a través de medidas de dispersión de energía de rayos X. |
el análisis de la composición química a través de medidas de dispersión de energía de rayos X y el estudio de las bandas de absorción en el infrarrojo en el rango de energías de 600 a 4000 cm-1. |
Los resultados indican un marcado proceso endotérmico alrededor de 264 ºC, el cual corresponde al cambio de estructura de goetita ortorrómbica (Pbnm) a hematita romboédrica (R3c ). Además, se detecta tres puntos de inflexión en la pérdida porcentual de masa a las temperaturas de 50, 190 y 290ºC. Estos cambios están fuertemente relacionados con la deshidroxilación de la fase limonita a goethita, -FeO(OH), y posteriormente a hematita,, -Fe2 O3. |
| Hidroxido de amonio y FeCl2.4H2O | Método de precipitación | El modelo de difracción de rayos X indico que las nanopartículas de Fe3O4 fueron puras con una estructura espiral. Las nanopartículas fueron caracterizadas por la difracción de rayos X (XRD). | Las propiedades magnéticas de las nanopartículas fueron estudiadas usando muestras vibracionales con un magnómetro de vibraciones. En el cálculo de la saturación magnética se ha usado 0.0095 g de la muestra, el valor experimental del momento magnético de 2.07 da un valor de 217.9 emu/g a una temperatura de 301.5 K. |
2. Experimentación
2.1 Determinación del peso de los compuestos
- Para pesar los compuestos (CoCl2 y FeCl3.6H2O) se realizaron pequeños recipientes de aluminio.
- Aplicando la formula (1) obtuvimos los pesos de cloruro de cobalto y cloruro férrico, como se muestra a continuación:
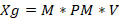 (1)
(1)Dónde: Xg= Peso (gramos); M= molaridad; PM= peso molecular (gramos / mol); V= volumen (litros).
1.- Cloruro de Cobalto. (CoCl2)
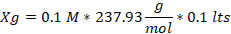
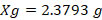
2.- Cloruro Férrico. (FeCl36H2O)
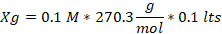
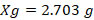
2.2 Síntesis de óxido de cobalto y óxido de hierro
- Colocamos un agitador en el vaso de precipitado y vaciamos el cloruro de cobalto (compuesto), con la cantidad antes ya especificada.
- En otro vaso de precipitado medimos el solvente: 100 ml de agua destilada y 100 ml de alcohol etílico (para la segunda síntesis) y agregamos este líquido al vaso que contenía cloruro de cobalto.
- Las parrillas las cubrimos de aluminio para prevenir impurezas al momento de ser utilizadas.
- Colocamos el vaso de precipitado con la mezcla correspondiente (compuesto + solvente) sobre la parrilla, y la encendimos en modo vibrador dejándolo con un tiempo de 30 minutos; medimos el PH.
- Con la pinza sujetamos la pipeta y agregamos, como agente precipitante, el hidróxido de amonio aprox. 10 ml., colocamos la pipeta cerca del vaso de precipitado que contenía la mezcla de cloruro de cobalto con agua destilada (compuesto + solvente), abrimos la pipeta de modo que el hidróxido de amonio cayera por goteo (solo 4 ml). De nuevo se midió el PH.
- Agitamos manualmente el contenido del recipiente (compuesto + solvente + agente precipitante), con el mayor cuidado posible evitando derrames. Encendimos de nuevo la parrilla en modo vibrador, dejamos agitar la mezcla por 20 min.
- Sellamos el vaso de precipitado que contenía la mezcla, con parafilm y con papel aluminio.
- La suspensión de partículas fue de 48 horas. Después separamos el sobrenadante de la mezcla precipitada; obtuvimos una mezcla un poco espesa la cual fue calentada para obtener el polvo, ya que tenía cierta humedad e impurezas. Realizamos el mismo procedimiento para: el cloruro de cobalto con alcohol etílico, cloruro férrico con agua destilada y cloruro férrico con alcohol etílico, todas ellas se les agregó hidróxido de amonio (4 ml) como agente precipitante y el solvente que fue utilizado fue de 100 ml para cada síntesis.
En la tabla 2 y 3 se muestran los datos más relevantes obtenidos en la síntesis diferenciando algunos parámetros; presentándolos antes de calcinar y después de calcinar respectivamente.
Tabla 2 Síntesis de óxido de cobalto y óxido de hierro (antes de calcinar)
| Nombre de la muestra | Compuesto (Cantidad, g) | Tipo de solvente | PH | Tiempo de calentado (h) | Peso de los polvos (g) | |
| Compuesto + solvente | Compuesto + solvente + agente precipitante | |||||
| Co-A-0 | Cloruro de cobalto. (CoCl2) 2.4 |
Agua destilada | 5 | 7 | 2 | 0.802 |
| Co-E-0 | Alcohol etílico | 8 | 8 | 1.071 | ||
| Fe-A-0 | Cloruro Férrico. (FeCl36H2O) 2.726 |
Agua destilada | 1 | 10 | 3.5 | 1.104 |
| Fe-E-0 | Alcohol etílico | 3 | 8 | |||
Tabla 3 Síntesis de óxido de cobalto y óxido de hierro (después de calcinar)
| Nombre de la muestra | Compuesto (Cantidad, g) | Tipo de solvente | Calcinación. | Polvo calcinado (g) | |
| Temperatura (°C) | Tiempo (h) | ||||
| Co-A-500 | Cloruro de cobalto. (CoCl2) 2.4 |
Agua destilada | 500 | 2 | 0.401 |
| Co-E-500 | Alcohol etílico | 0.5355 | |||
| Fe-A-500 | Cloruro Férrico. (FeCl36H2O) 2.726 |
Agua destilada | 500 | 2 | 0.552 |
| Fe-E-500 | Alcohol etílico | 0.780 | |||
3. Análisis Raman
La espectroscopia Raman vibracional, en este amplio sentido, es una técnica extremadamente versátil que se usa en el seguimiento y en el control de varios fenómenos que están enmarcados en disciplinas como química, física y ciencia de los materiales.
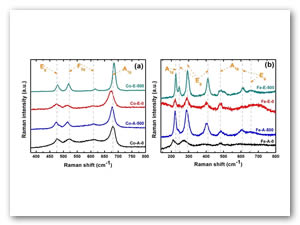
La Figura 1(a) muestra los polvos de óxido de cobalto y la imagen 1(b) muestra los polvos de óxido de hierro, los espectras que se aprecian en ambas figuras son de color azul y negra, respectivamente; en ambos casos el solvente es agua, mientras que en los espectras de color rojo y verde el solvente es alcohol etílico. Se puede apreciar la intensidad de los espectras después de calcinar los polvos, debido a que se cristalizan, ya que antes de calcinar estos polvos se encuentran amorfos.
Los modos Eg, F2g, A1g, mostrados en la imagen 1(a) son los modelos vibracionales del óxido de cobalto, de acuerdo a las características que se muestran nos confirma que sintetizamos el óxido de cobalto correctamente. Los modos A1g, Eg, mostrados en la imagen 1(b) son los modelos vibracionales del óxido de hierro, de acuerdo a las características que se muestran también nos confirma que sintetizamos el óxido de hierro.
Existe diferencia entre los solventes: el etanol es más cristalino que el agua, el cual indica que el etanol es mejor solvente, ya que cristaliza mejor debido a que tiene – OH.
El shift presente en el etanol en el espectro Co-E-500 tiende a la derecha esto indica que presenta una mayor calidad y es mejor que el espectro Co-A-5000 el cual tiende a la izquierda.
4. Conclusiones
Al calcinar los polvos de óxido de cobalto y óxido de hierro y aplicar el análisis Raman se confirmó que los polvos obtenidos en la síntesis fueron de calidad, sin embargo, la diferencia entre los solventes (alcohol etílico y agua destilada) fue notable por lo que el solvente que mostro un mejor resultado fue el alcohol etílico, ya que este presento una mejor cristalización y el shift tendió hacia la derecha lo cual indica que presenta una mayor calidad.
5. Agradecimientos.
Le agradecemos al personal encargado de laboratorio de la escuela superior Tepeji por la atención brindada para poder realizar la síntesis, posteriormente agradecemos la ayuda brindada a nuestros compañeros los cuales nos apoyaron en la realización de este proyecto.
Referencias Bibliográficas
Bersani,, D., Lottici, P., & A. Montenero, A. (1998). Micro-Raman Investigation of Iron Oxide Films. JOURNAL OF RAMAN SPECTROSCOPY, 355-360.
Gino , P., Sun Kou, M., Aguilar, Y., López, A., & Arruebo, M. (2010). Sensores basados en óxido de Fe dopados con Ag para la detección de sulfuro de hidrógeno. Soc Quím Perú, 199-217.
Jie , H., Fanqin , G., Zhenting , Z., Shengbo , S., Pengwei, L., Wendong , Z., . . . Yong , C. (2016). Synthesis and characterization of Cobalt-doped ZnO microstructuresfor methane gas sensing. EL SEVIER, 1-8.
Kandpal, N., Sah, N., Loshali, R., Joshi, R., & Prasad, J. (2014). Co-Precipitation method of synthesis and characterization of iron oxide nanoparticles. Journal of Scientific & Industrial Research, 87-90.
M., Q. F. (2016). Reduced Graphene Oxide (rGO) Encapsulated Co3O4. Sensors and Actuators B (EL SEVIER), 1-4.
Palacios, P., De Los Santos Valladares, L., Bustamante, A., & González, J. (2012). Estudio de la deshidroxilación en el óxido férrico hidratado denominado limonita. Soc Quím Perú, 198-206.
Seema , J., Vinayak B, K., Manoj, K., & Arun, M. (2015). Nickel Substitution Induced Effects on Gas Sensing Properties of Cobalt. Journal of Alloys and Compounds, 2-4.
Soyeon, M., Nguyen Minh , V., Dongsuk , L., Dahye , K., Hyundong , L., Dojin , K., . . . Soon-Gil , Y. (2016). Co3O4–SWCNT composites for H2S gas sensor application. EL SEVIER, 1-7.
Turrel , G., & Corset , J. (1996). Raman microscopy. Developments and applications. Academic Press,, 243.
Yang, J., Hongwei , L., Wayde N. Martens, N., & Ray. (2010). Synthesis and Characterization of Cobalt Hydroxide, Cobalt Oxyhydroxide, and Cobalt. American Chemical Society, 111-118.
[a] Escuela Superior de Tepeji, Ingeniería Industrial, Universidad Autónoma del Estado de Hidalgo, yir_enero_96_@hotmail.com
[b] Escuela Superior de Tepeji, Ingeniería Industrial, Universidad Autónoma del Estado de Hidalgo, nancy_nba@outlook.com
[c] Escuela Superior de Tepeji, Ingeniería Industrial, Universidad Autónoma del Estado de Hidalgo, krishnakarthik.tv@gmail.com