Óxidos metálicos de hierro y manganeso: inhibición en microorganismos
Resumen
Existen en la actualidad una infinidad de sustancias con propiedades antimicrobianas de entre las cuales podemos encontrar a materiales de origen orgánico e inorgánico, dentro de las sustancias orgánicas se hace referencia a los antibióticos de origen natural o que son obtenidos de rutas sintéticas orgánicas; también tenemos a los de origen inorgánico de entre los cuales podemos encontrar a los metales cerovalentes o en su forma de óxido, siendo el mercurio el que más presenta letalidad para una gran cantidad de microorganismos. Se determina la actividad antimicrobiana de los óxidos de hierro y manganeso caracterizados por espectroscopia UV-Vis, determinando la densidad óptica cuando estos son expuestos en medio líquido a bacterias gram positivas y negativas, se determinan las propiedades bacteriostáticas de los óxidos de hierro y manganeso obtenidos por síntesis químico-biológica, los óxidos presentan un efecto inhibitorio en el crecimiento de bacterias gram positivas y negativas, efectos letales en los microorganismos no se aprecian por lo que el óxido se muestra como agente bacteriostático; los mismos podrían ser incluidos en otros materiales para inhibir el crecimiento de microorganismos indeseados, este proyecto es derivado de la colaboración de instituciones hidalguenses que conforman la red ingeniería de procesos avanzados de sistemas ambientales.
Palabras clave: óxido, hierro, manganeso, susceptibilidad, antimicrobiano
Abstract
Actually, exists several substances with antimicrobial properties among which we can find organic e inorganic-based materials, organic substances are referred to antibiotics of natural origin or obtained by synthetic routes; inorganic origin materials are zero-valued metals and/or their oxide forms like a mercury which represent the most lethal material for a large number of microorganisms. The antimicrobial activity of iron and manganese oxides was determined, measuring the optical density when these materials are exposed in a liquid medium to gram positive and negative bacteria, the bacteriostatic properties of iron and manganese oxides obtained by chemical-biological synthesis were analyzed. The oxides show an inhibitory effect on the growth of gram positive and negative bacteria, lethal effects on microorganisms are not appreciated so the oxides are a bacteriostatic agent. These oxides could be included in other materials to inhibit the growth of undesired microorganisms; this project is made for Universities of Hidalgo State in academic collaboration.
Keywords: oxides, iron, manganese, susceptibility, antimicrobial
Introducción
Existen en la actualidad una infinidad de sustancias con propiedades antimicrobianas de entre las cuales podemos encontrar a materiales de origen orgánico e inorgánico, dentro de las sustancias orgánicas se hace referencia a los antibióticos de origen natural o que son obtenidas de rutas sintéticas orgánicas; también tenemos a los de origen inorgánico de entre los cuales podemos encontrar a los metales cerovalentes o en su forma de óxido, siendo el mercurio el metal con mayor letalidad para una gran cantidad de microorganismos. Actualmente, algunos metales se encuentran presentes en agua para consumo humano siendo este un medio de contaminación ambiental, sin embargo existen tecnologías para realizar una remediación de metales pesados en agua destinada para el consumo humano. Al tratar estas aguas residuales y efectuar la remediación, los residuos con contenido de metales pesados podrían ser utilizados en diferentes aplicaciones de índole tecnológica.
En algunos casos los metales pueden tener propiedades antimicrobianas en contra de una amplia variedad de microorganismos como lo pueden ser hongos, bacterias o virus, el mecanismo de acción de los metales en contra de los microorganismos puede ser variado, el metal puede desnaturalizar y colapsar la membrana celular o penetrar hasta el núcleo de la célula e inhibir replicación del material genético. El siguiente trabajo de investigación se centra en el estudio de la inhibición de microorganismos, se aislaron tanto bacterias gram positivas y gram negativas las cuales fueron expuestas a óxidos obtenidos por métodos químico-biológicos.
Antecedentes
La precipitación química es uno de los procesos más efectivos utilizados para la remoción de metales pesados en agua porque es relativamente simple y de muy bajo costo en los procesos de operación, los químicos reaccionan formando precipitados insolubles que pueden estar separados del agua por sedimentación o filtración; una vez tratada el agua es decantada y apropiadamente descargada o reutilizada. (Fenglian Fu, 2011)
La precipitación química en combinación con otros métodos han demostrado tener una alta efectividad, por ejemplo, se ha utilizado la precipitación de metales pesados vía precipitación química en conjunto con la nanofiltración en un segundo paso. Los resultados demuestran que la remoción alcanza porcentajes de eliminación altos. También algunos estudios demuestran la precipitación química en combinación con tratamientos de intercambio iónico; donde se ha removido níquel desde aguas residuales en un 74 % al utilizar este proceso pero si se realiza en conjunto con el intercambio iónico puede removerse un 98%. (Fenglian Fu, 2011)
La Química se relacionada a la Ciencia e Ingeniería de los Materiales, entre ambas se crean cuando el hombre adquiere la conciencia de fabricar nuevos materiales o al utilizar y modificar los materiales naturales, a través de procesos que necesitaban del fuego; percibía la Química oculta tras su trabajo y es notorio su avance hasta la actualidad. (SALAS-BANUET GUILLERMO & EUGENIA, 2012)
Un óxido en la vida cotidiana nos hace referencia al sarro rojizo que se forma en los metales por ejemplo en las laminas de los automóviles y partes del motor y que se considera como un deterioro del material. La herrumbre y oxidación corresponde a la acción combinada de la humedad y el oxígeno del aire sobre el metal, por lo que podemos evitarla si protegemos al metal, por ejemplo cubriéndolo con una capa de pintura anticorrosiva. (Gutierrez, 2002)
La corrosión de un metal concierne al proceso que igualmente los químicos llaman oxidación, de la misma forma podemos oxidar a un elemento tal como el carbono o bien oxidar sustancias de origen animal o vegetal o derivados del petróleo (gasolinas) cuando se les adiciona energía calorífica, generando así una gran cantidad y variedad de óxidos. La oxidación de la película de aluminio de los discos compactos es precisamente el factor que puede limitar la duración de estos sistemas para reproducir música y almacenar información. Cualquier oxidación química corresponde a la pérdida de electrones por la acción de un agente oxidante. (Gutierrez, 2002)
El oxígeno es apto para oxidar a otros compuestos químicos, existen sustancias oxidantes aun más potentes; el ozono es un agente tóxico con un fuerte poder oxidante y se produce en las ciudades por la acción de la luz solar sobre el dióxido de nitrógeno que a su vez es un contaminante generado principalmente por los automóviles. Sin embargo, el ozono también se produce en forma natural en las capas altas de la atmósfera donde tiene un papel fundamental para la vida ya que neutraliza la radiación ultravioleta que proviene del espacio exterior. (Gutierrez, 2002)
Los óxidos se han estado produciendo permanentemente desde el mismo momento del origen de la Tierra, muchísimo antes que hubiera herramientas u otros artículos metálicos elaborados por el humano. Una de las especies químicas más abundantes a nivel de la corteza terrestre es el dióxido de silicio, siendo el cuarzo una de sus formas cristalinas naturales más conocidas. La abundancia de dióxido de silicio no es casual ya que el oxígeno junto con el silicio son de los elementos más abundantes de la corteza terrestre, representando en conjunto unas tres cuartas partes del peso de muestras de suelo. (Gutierrez, 2002)
Derivado de la actividad industrial de plantas de metales, industrias fertilizantes, industria del papel y pesticidas, los metales pesados de estas aguas residuales son directamente descargados al medio ambiente incrementando la contaminación. Los metales pesados no son biodegradables y tienden a acumularse dentro de las células vivas de organismos y es bien sabido que pueden ser tóxicos y carcinogénicos. (Fenglian Fu, 2011)
La toxicidad de los metales pesados y en particular de aguas residuales incluyen al zinc, cobre, níquel, mercurio, cadmio, plomo y cromo, sin embargo algunos de estos pueden filtrarse a mantos acuíferos subterráneos y contaminar aguas de pozos y manantiales que son destinados para el consumo humano. (Fenglian Fu, 2011)
Los metales pesados han llegado a ser un serio problema ambiental por lo que es prioridad removerlos mediante tratamientos de las aguas residuales a fin de proteger al medio ambiente y la salud humana. Existen algunos métodos que han empezado a ser utilizados para remover a los metales pesados en forma de iones por precipitación, intercambio iónico, absorción, filtración por membrana y tratamientos electroquímicos. (Fenglian Fu, 2011)
Los sedimentos acuáticos son repositorios donde actúan una gran variedad de contaminantes orgánicos e inorgánicos, los contaminantes están inmovilizados en un ecosistema acuático o sujetos a transformaciones mediante activación de procesos. Contrario a los metales pesados, éstos pueden ser transformados por procesos biológicos resultando algunas veces en la mineralización del metal. Los sedimentos acuáticos se encuentran en condiciones anaeróbicas y la presencia de carbono en los mismos, representan en recursos con una amplia variedad de microorganismos con un potencial de degradación de contaminantes orgánicos. (Perelo, 2010)
Algunos materiales pueden reaccionar con el oxígeno además de otros gases, las reacciones alteran la composición y las propiedades químicas o la integridad del material en cuestión. Los metales reaccionan con el oxígeno para producir un óxido y pueden verse afectados por la facilidad con la que se realiza la reacción, la naturaleza del óxido formado y la cinética de reacción. (Gudepalya Renukaiah Rudramurthy, 2016)
Los óxidos de manganeso son altamente reactivos y juegan un papel importante en los ciclos biogeoquímicos. Los óxidos de Mn son algunos de los más fuertes antioxidantes que se encuentran naturalmente en el medio ambiente, y como tales, participan en una amplia gama de reacciones redox con especies químicas orgánicas e inorgánicas. Muchas de las bacterias pueden utilizar los óxidos de Mn como aceptor de electrones para la oxidación de la materia orgánica o H2 en la ausencia de oxígeno. Óxidos de Mn también tienen alta capacidad de absorción y, por lo tanto, absorben una amplia gama de iones, controlando las distribuciones y la biodisponibilidad de muchos elementos tóxicos y esenciales. (Bradley M. Tebo, 2004)
Los óxidos de manganeso en la naturaleza tienen la capacidad de absorber varios metales como el selenio, plomo, arsénico y los iones de cromo. Además de la capacidad de adsorción de metales contaminantes, presentan un aumento de la reactividad debido a defectos estructurales, como las vacantes de cationes. Varios compuestos orgánicos e inorgánicos, incluyendo metales pesados disueltos, se pueden oxidar químicamente en presencia de MnO2. Durante este proceso, el MnO2 insoluble se reduce en Mn (II) soluble, este proceso se produce de forma rápida y a temperatura ambiente y pH neutro. (Bradley M. Tebo, 2004)
Las sustancias antimicrobianas pueden ser de origen sintético o semi-sintéticos, de origen natural (es decir, de las plantas y animales). El uso inadecuado de los antimicrobianos ha llevado al desarrollo de bacterias resistentes a múltiples fármacos y que es uno de los mayores retos para los profesionales de la salud y es una amenaza mundial importante. La principal preocupación con el desarrollo de la resistencia a los antimicrobianos es la propagación de microorganismos resistentes, la sustitución de los antimicrobianos convencionales por las nuevas tecnologías para contrarrestar la resistencia a los antimicrobianos es continuo. (Gudepalya Renukaiah Rudramurthy, 2016)
Recientemente, debido a la resistencia a antimicrobianos a las drogas sintéticas, ha habido una tendencia hacia los agentes derivados de plantas que presentan propiedades antimicrobianas, tales como el uso de aceites esenciales. A pesar de sus efectos probados como antimicrobianos, el uso de aceites esenciales es aún limitado en terapias médicas debido a la poca estabilidad y la alta volatilidad de los compuestos activos. (Ioannis Liakos, 2014)
Metodología
- Aislamiento de bacterias Gram (+) y Gram (-)
Las bacterias se obtuvieron del laboratorio de la Universidad Autónoma del Estado de Hidalgo y de la Universidad Tecnológica de Ciudad Juárez, el aislamiento incluye tres tipos de bacterias: E. coli (UAEH), S. epidermidis (UTCJ) y Enterococcus faecalis (UAEH), para las bacterias se incubaron en medios apropiados para su posterior aislamiento. Finalmente, se preparó una suspensión de bacterias para ser expuestas a los óxidos metálicos a estudiar.
- Aislamiento de bacterias
Para E. Coli y S. epidermidis se utiliza agar para métodos estándar para llevar a cabo el aislamiento mediante la técnica de estriado, las cajas Petri se incubaron durante 48 h a 38 ºC centígrados, posteriormente la colonia aislada se propaga en tubos inclinados provistos con agar para métodos estándar incubando estos tubos durante 48 h a una temperatura de 38ºC. El agar para métodos estándar fue preparado como sigue: se pesaron 2.82g de agar y se disolvió en 120 mL de agua destilada, la mezcla se calentó en parrilla eléctrica a 100 ºC hasta ebullición. Del agar preparado se tomaron 5 mL y se colocaron dentro de los tubos de ensayo, los cuales se esterilizaron en autoclave por 20 min a 15 Lb/pulg2. Al término de la esterilización, los tubos se colocaron en una base lisa en ángulo de 10°C hasta que gelificaran para después refrigerar. Para la siembra de microorganismos, se tomaron colonias de E. coli y se sembraron en los tubos de ensayo con agar para métodos estándar empleando la técnica de estriado, de esta manera se sembraron 6 tubos con E. Coli repitiendo el procedimiento para S. epidermidis. Los tubos se incubaron a 38°C por 48 h.
- Aislamiento de bacterias en Agar M para enterococos
Para Enterococcus faecalis se utiliza agar M, donde se toma una azada del microorganismo y se realiza el método de estría para el aislamiento, se incuba durante 48 h a 38 ºC centígrados, posteriormente la colonia aislada se propaga en tubos inclinados que contenían agar para métodos estándar de forma igual se incuba durante 48 h a una temperatura de 38ºC. Se siguen la misma metodología para el aislamiento, sin embargo el medio de cultivo se prepara de la siguiente forma: Se suspende 42 g de polvo en 1L de agua purificada. Se mezcla de forma uniforme y se calienta agitando frecuentemente y se deja hervir durante 1 min para disolver completamente el polvo, este medio no se ha esterilizado en el autoclave de acuerdo con las instrucciones del fabricante. Al finalizar el aislamiento, se obtienen medios de cultivos puros en agar para métodos estándar y agar M para enterococos, se refrigeraron y se utilizaron en un tiempo menor a un mes, después de este tiempo se resiembra las cepas para mantener viables los microorganismos.
- Determinación de la actividad antimicrobiana de los óxidos
Para la obtención de muestras de óxidos metálicos obtenidos por vía químico-biológica se obtuvieron 3 clases de óxidos, el primero fué utilizando un agua modelo con iones fierro o manganeso donde se precipitó el ión junto con almidón que se extrajó de Solanum tuberosum L. el cual remueve los iones tanto de hierro y manganeso del agua, el extracto utilizado puede ser de utilidad para la remoción de iones de metales pesados en aguas de pozos, posteriormente se llevó a cabo una reducción con borohidruro de sodio para obtener el óxido tanto de hierro y manganeso. En el segundo método se realizaron patrones de óxidos realizados con borohidruro de sodio y polivinilpirrolidona como agente estabilizante para realizar una comparación entre los óxidos obtenidos con el extracto de Solanum tuberosum L. y un óxido obtenido utilizando solamente del borohidruro de sodio. El tercer método incluye un coloide que mantiene los óxidos en un estado de suspensión de hierro y manganeso. Para el extracto de papa se realizó la siguiente metodología, para realizar el extracto se calentaron hasta ebullición 50 g de papa en 250 mL de agua destilada. Posteriormente con un embudo, utilizando algodón como medio filtrante, se filtró el agua que se calentó con las papas obteniéndose 216 mL de filtrado al cual se agregaron 2.16 g de dextrosa. Este líquido fue utilizado como cultivo líquido donde se hizo crecer a los microorganismos para el primer tipo de óxidos, los cuales fueron precipitados expuestos a un precursor de Fe y Mn y posteriormente tener la reducción.
Se prepararon las siguientes soluciones:
• Solución de hierro: se pesaron Fe 0.1 g en 50 mL de agua destilada: FeSO4·7H2O (PM: 278).
• Solución de manganeso: se pesaron 0.1 g de Mn en 50 mL de agua destilada: MnSO4 (PM: 169.02).
• Solución de PVP: Se disuelve 0.1 g en 50 mL de agua destilada.
• Solución de reductor: NaBH4 0.5 g en 100 mL.
En tubos de ensayo se agregaron los siguientes volúmenes:
• 1: 5 mL de Mn, 5 mL de NaBH4; Relación 1:1 en peso.
• 2: 5 mL de Fe, 5 mL de NaBH4; Relación 1:1 en peso.
• 3: 5 mL de Mn, 5 mL de NaBH4, 2 mL de PVP: Relación 1:1.
• 4: 5 mL de Fe, 5 mL de NaBH4, 2 mL de PVP: Relación 1:1.
Se prepararon la siguiente muestras en relación 1:1 pero se incluyó un proceso de sonido a 30 Hz durante 30 min:
• 5: 5 mL de Mn, 5 mL de NaBH4; Relación 1:1 en peso.
• 6: 5 mL de Fe, 5 mL de NaBH4; Relación 1:1 en peso.
• 7: 5 mL de Mn, 5 mL de NaBH4, 2 mL de PVP: Relación 1:1.
• 8: 5 mL de Fe, 5 mL de NaBH4, 2 mL de PVP: Relación 1:1.
Al finalizar una relación 1:1 en volumen de cada óxido se expone con el microorganismo E. coli y S. epidermidis, el medio líquido en el que se suspendieron contiene 4 mL de agar papa-dextrosa líquido y 1 mL de suspensión 0.1 MF.
Se realizó una prueba agregando líquido de glucosa al 10% al medio de cultivo en relación 1:1 y los óxidos obtenidos por reducción química a una concentración 10-2 M utilizando como estabilizante la PVP, se incubaron ambos microorganismos (E. coli y Enterococcus faecalis) durante 48 h a 38 ºC en medio líquido de glucosa.
- Caracterización de óxidos metálicos
Las muestras fueron caracterizadas por espectroscopia ultravioleta-visible donde se realizaron barridos de entre 190 y 800 nm, obteniendo los espectrogramas correspondientes a los óxidos de hierro y manganeso.
Materiales
- Agar para Métodos Estándar.
- Agar M para enterococos.
- Precursores de Fe y Mn.
- NaBH4 Sigma Aldrich.
- Cristalería de laboratorio.
- Espectrofotómetro UV-Vis (ThermoScientific Genesys 10S).
Resultados y discusión
- Aislamiento de bacterias Gram (+) y Gram (-) por métodos estándar y agar M para enterocococos
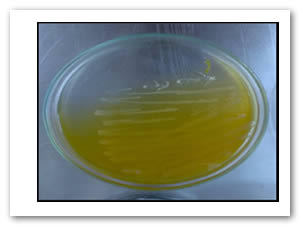
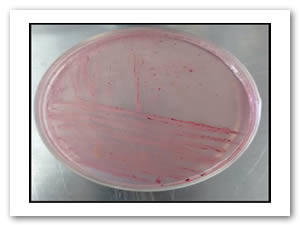
Con las muestras de microorganismos se realizó un aislamiento por estría, la colonia aislada fue propagada en tubos con medios de cultivo y posteriormente se realizaron las pruebas antimicrobianas. Las figuras 1 y 2 muestran el aislamiento utilizado para E. coli y Enterococcus faecalis. Al obtener un cultivo puro, se aisló en tubo de ensaye y se prepararon las suspensiones McFarland para exponer los óxidos a los microorganismos.
- Determinación de la actividad antimicrobiana de los óxidos
Para los dos primeros tipos de óxidos se realizaron pruebas de halo inhibitorio, los óxidos tanto de hierro como manganeso obtenidos tanto por extracto de papa como por reducción química no presentan halos de inhibición para E. coli y Enterococcus faecalis sin embargo el crecimiento se muestra inhibido por debajo del disco. Se agrega a cajas Petri agar de sales de manganeso y nutritivo; posteriormente se extendió superficie 100 µL de una suspensión 1 MF; para todos los casos se utilizó un blanco de agua estéril. Al terminar se agrega dos tipos de control uno de agua destilada y otro de penicilina (resistente a la cepa). Al terminar se agregaron sensidisco con 1.0, 2.0, 3.0, 4.0, 5.0 y 6.0 µL de los siguientes óxidos:
- 1: Fe/NaBH4/PVP.
- 7: Mn/NaBH4/PVP.
- 4: Fe/ extracto de papa.
- 9: Mn/ extracto de papa.
- UAEH óxido de Mn.
Para todos los casos no se obtienen halos de inhibición debido a que el antimicrobiano se aglomera en el papel filtro y la difusión al medio de cultivo en la caja Petri no es la adecuada por lo que se realizó otra prueba donde se exponen directamente los óxidos de hierro y manganeso en medio líquido. La Fig. 3 muestra las pruebas realizadas.
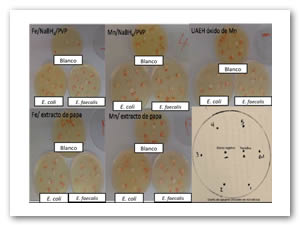
Fig. 3: Pruebas de sensidisco para diferentes tipos de óxido de hierro y manganeso con bacterias gram (+) y gram (-). El halo de inhibición por debajo del papel filtro corresponde a 6.67 mm en promedio para todos los casos
Se realiza una prueba donde se agrega una relación 1:1 con el medio de cultivo líquido de glucosa al 10% y de los óxidos obtenidos por reducción química a una concentración 10-2 M utilizando como estabilizante PVP, se incubaron dos microorganismos tanto E. coli como Enterococcus faecalis durante 48 h a 38 ºC en medio líquido de glucosa. Al finalizar la incubación se realiza la medición de la densidad óptica a 600 nm de cultivos con y sin óxidos metálicos obteniendo la absorbancia, la transmitancia y la unidad McFarland. Los datos de una primera prueba se muestran en la tabla No.1.
Tabla No. 1: Resultados de la densidad óptica a 600 nm para las pruebas de inhibición en bacterias gram positivas y gram negativas
| Blanco | Óxido de hierro | ||
| E. faecalis | %T | 95.3 | 97.1 |
| ABS | 0.3 | 0.21 | |
| MF | 0.01 | 0.006 | |
| Blanco | Óxido de manganeso | ||
| E. faecalis | %T | 95.3 | 98.2 |
| ABS | 0.3 | 0.4 | |
| MF | 0.01 | 0 | |
| Blanco | Óxido de hierro | ||
| E. Coli | %T | 95.2 | 94 |
| ABS | 0.33 | 0.33 | |
| MF | 0.0166 | 0.03 | |
| Blanco | Óxido de manganeso | ||
| %T | 95.2 | 94.2 | |
| ABS | 0.33 | 0.35 | |
| MF | 0.0166 | 0.0188 |
Las pruebas muestran la inhibición del crecimiento para Enterococcus faecalis, sin embargo las pruebas para E. coli muestran un crecimiento en presencia de los óxidos de hierro y manganeso. La concentración a la cual se encuentran los óxidos en ambos casos durante la prueba de inhibición es 0.004M.
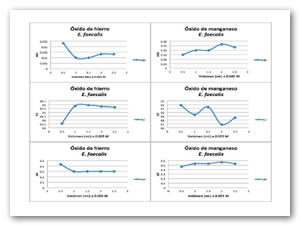
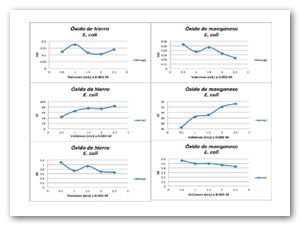
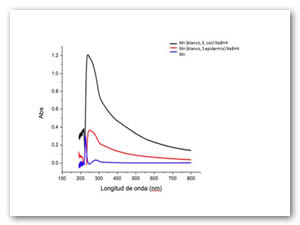
Para las pruebas de las especies químicas en estado coloidal, la concentración a la cual se encuentran es 0.005 M. Se agregan diferentes volúmenes de compuestos antimicrobianos (0.5-2.5 mL) a un medio de cultivo de glucosa con microorganismos gram positivos y negativos en este caso fue el Enterococcus faecalis y la E. coli hasta completar un volumen de 10 mL, los tubos se realizaron por triplicado e incubaron durante 48 h a 35 ºC. Después se midió la densidad óptica a 600 nm en unidades McFarland, absorbancia y transmitancia. Se obtienen las gráficas correspondientes reportando solo el promedio de las pruebas por triplicado. Tanto para las bacterias gram positivas como negativas las especies químicas coloidales se inhibe el crecimiento de los microorganismos, debido a que las gráficas no alcanzan a multiplicar de forma logarítmica. La fig. 4 y Fig. 5 presentan las gráficas para E. coli y Enterococcus faecalis donde se muestra la actividad antimicrobiana de los óxidos de hierro y manganeso.
Se utilizan coloides de hierro y manganeso debido a que estos se encuentran dispersados y están en contacto directo con la suspensión de los microorganismos, al parecer no existen diferencia en la inhibición si los óxidos se encuentran en estado coloidal o parcialmente precipitados. Los óxidos antimicrobianos presentan un efecto inhibitorio en el crecimiento de bacterias gram positivas y negativas, efectos letales en los microorganismos no se aprecian por lo que el óxido se muestra como agente bacteriostático.
Caracterización de óxidos metálicos
En esta etapa se obtuvieron 3 clases de óxidos, el primero fué utilizando un agua modelo con iones fierro o manganeso donde se precipitó el ión junto con almidón que se extrajo de Solanum tuberosum L. el cual remueve los iones tanto de hierro como de manganeso del agua, el extracto utilizado puede ser de utilidad para la remoción de iones de metales pesados en aguas de pozos, posteriormente se lleva a cabo una reducción con borohidruro de sodio para obtener el óxido tanto de hierro y manganeso.
El segundo método se realizaron patrones de óxidos realizados con borohidruro de sodio y polivinilpirrolidona como agente estabilizante para realizar una comparación entre los óxidos obtenidos con el extracto de Solanum tuberosum L. y un óxido obtenido utilizando solamente del borohidruro de sodio. El tercer método incluye un coloide que mantiene los óxidos en un estado de suspensión de hierro y manganeso.
Las muestras fueron caracterizadas por espectroscopia ultravioleta-visible donde se realizó un barrido de entre 190 y 800 nm, obteniendo los espectrogramas correspondientes a los óxidos de hierro y manganeso.
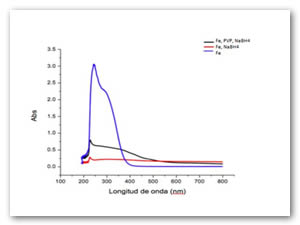
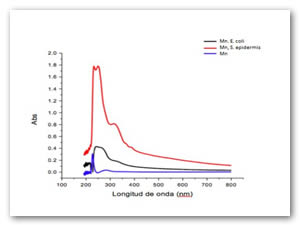
La Fig. 6 corresponde al precursor de hierro utilizando como agente precipitante el extracto de papa antes de ser oxidado, en presencia de dos microorganismos, el extracto en este punto precipito los iones Fe, antes de llevar a cabo la reacción.
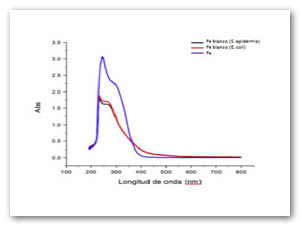
Fig. 6: Iones hierro antes de ser reducidos, la disminución del plasmón de superficie indica la floculación dentro de la solución.
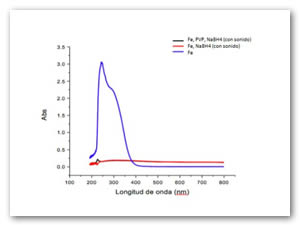
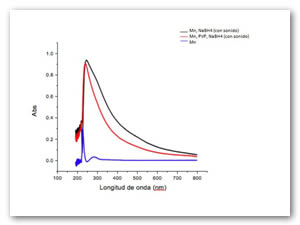
La Fig. 7 representa los óxidos químicos obtenidos con un estabilizante PVP de borohidruro de sodio como agente reductor de los iones hierro, al finalizar la reacción no existen los plasmones de superficie debido a que se encuentran precipitados dentro de la cubeta utilizada en espectroscopia ultravioleta-visible. Se muestra la solución dispersada mediante ultrasonido con y sin estabilizante, en ambos casos precipitan. La línea azul representa los iones fierro antes de oxidarse. Las pruebas utilizando ultrasonido demuestran que la reacción es acelerada y lo óxidos precipitan totalmente. Los plasmones son obtenidos a las 0.1 horas de haber agregado el borohidruro de sodio.
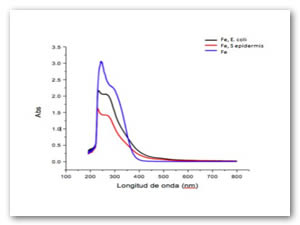
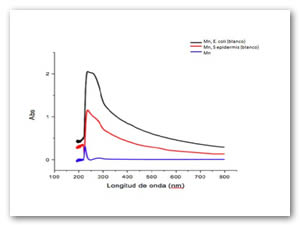
La fig. 8 representa los plasmones de resonancia superficiales de iones Fe después de 48 h de exposición al extracto de papa y en presencia de los microorganismos. La disminución de la intensidad de los picos representa que solo esta floculando los iones fierro sin que las bacterias oxiden a los iones. La línea azul representa los iones hierro.
Las muestras sin realizar un tratamiento sónico demuestran un plasmón de resonancia superficial que puede ser indicativo de un material nanoestructurado presente en estado coloidal, como se muestra en la fig. 9, la PVP al ser un potente estabilizante permite la formación del nanomaterial y dejarlo como un coloide, sin embargo se muestra un precipitado en las muestras lo que es indicativo que parte del material queda suspendido en solución acuosa.
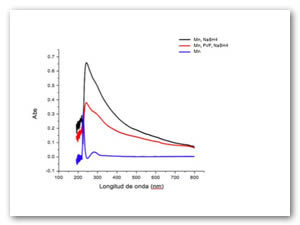
De igual forma, la polivinilpirrolidona (PVP) muestra que puede dejar al Mn en estado coloidal en general existe un efecto cuando se agrega la PVP en solución, los plasmones en la fig. 10 son leídos a las 0.1 h después de haber agregado el borohidruro de sodio.
La muestra utilizando un baño ultrasónico presenta un aumento en el plasmón de resonancia superficial de los óxidos, al tener el plasmón de resonancia superficial puede ser indicativo de la presencia de nanoestructuras a las 48 h de reacción utilizando un tratamiento ultrasónico como se muestra en la fig. 11.
La fig. 12 corresponde al precursor de manganeso utilizando como agente precipitante el extracto de papa antes de ser oxidado, en presencia de dos microorganismos, el extracto en este punto precipitó los iones Mn, antes de llevar a cabo la reacción.
La fig. 13 representa los plasmones de resonancia superficiales de Mn después de 48 h de exposición al extracto de papa y en presencia de los microorganismos. La disminución de la intensidad de los picos representa que solo está floculando los iones fierro sin que las bacterias oxiden a los iones. La línea azul representa los óxidos de manganeso.
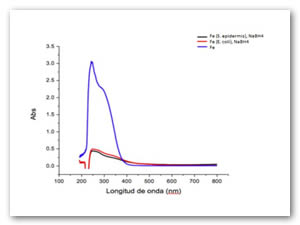
En esta ocasión tanto los iones hierro como manganeso no fueron oxidados con la presencia de microorganismos, el poder reductor tanto de las bacterias como las moléculas que componen el medio líquido no es suficiente para oxidar los iones, se necesita un agente reductor más fuerte como el borohidruro de sodio el cual muestra su poder reductor en los siguientes plasmones superficiales (fig. 14 y Fig. 15), las muestras fueron tomadas a las 48 h de reacción.
Los plasmones correspondientes a coloides de Mn y Fe en estado coloidal denotan un plasmón más intenso y el mismo va hasta la región visible de 800 nm. Las señales pueden indicar que se generan diferentes tipos de estructuras a nivel nanométrico o micrométrico.
Los óxidos de hierro y de manganeso se obtienen debido a que las propiedades antimicrobianas dependen mucho el estado fisicoquímico del óxido, si se encuentra en estado coloidal y se dispersa a través del medio de cultivo para estar en contacto directo con los microorganismos.
Conclusiones
Se determinan las propiedades bacteriostáticas de los óxidos de hierro y manganeso obtenidos por síntesis químico-biológica, los mismos podrían ser incluidos en otros materiales para inhibir el crecimiento de microorganismos indeseados en aplicaciones de ingeniería, pueden ser obtenidos de forma química, biológica o complementando ambos métodos. Es de gran importancia seguir estudiando las propiedades que tienen los óxidos de hierro y manganeso debido a su forma y morfología o tamaño pueden presentar diferentes propiedades físicas, químicas o biológicas; el trabajo en Red es fundamental para el intercambio de conocimientos, técnicas y resultados para generar productos de investigación como lo son artículos, reportes técnicos, etc. Las perspectivas son conocer diferentes metodologías para la síntesis de estructuras micro y submicrométricas que mejoren las propiedades fisicoquímicas y biológicas de los materiales obtenidos.
Agradecimientos
Que por su contribución a este trabajo agradezco al Programa para el Desarrollo Profesional Docente PRODEP por su apoyo en el proyecto de red denominado: “Remoción biológica de Fe y Mn de aguas subterráneas mediante la obtención de óxidos biogénicos con potencial de valor agregado”; Recursos PROFOCIE 2015 y al Programa de Formación, Proyecto Investigación Educativa. A la Dra. Claudia Coronel Olivares por el asesoramiento en el área de Microbiología de la Universidad Autónoma del Estado de Hidalgo. A Damaris Huerta Reyes y María Elizabeth Cardoso Castillo alumnas del Programa Educativo de Nanotecnología y Química Ambiental de la Universidad Tecnológica de Tula-Tepeji por su colaboración en la parte técnica de este proyecto. Dra. Mónica Galicia García y Dra. Marisela Aguirre Ramírez del departamento de Químico-Biológicas, ICB-Universidad Autónoma de Ciudad Juárez. Al Mtro. Rodolfo Salas Cepeda, Carlos Iván Rodríguez Rodríguez y Maricruz Rocha Rubio por su colaboración en este proyecto de la Universidad Tecnológica de Ciudad Juárez.
Referencias
1. Salas-Banuet Guillermo, R. B.-V., & Eugenia, N.-A. M. (2012). La QuíMica Y La Ciencia E IngenieríA De Los Materiales. DYNA , 79 (175), 70-96.
2. Bradley M. Tebo, J. R. (2004). Biogenic Manganese Oxides: Properties and Mechanisms of Formation. Rev. Earth Planet. Sci , 32 (2004), 287–328.
3. Fenglian Fu, Q. W. (2011). Removal of heavy metal ions from wastewaters: A review . Journal of Environmental Management , 92 (2011), 407-418 .
4. Gutierrez, J. A. (2002). Química de Todos los Días: Un Mundo de Óxidos . Acta Universitaria , 12 (3), 29-40 .
5. Gudepalya Renukaiah Rudramurthy, M. K. (2016). Nanoparticles: Alternatives Against Drug-Resistant Pathogenic Microbes. Molecules , 21 (836), 1-30.
6. Ioannis Liakos, A. M. (2014). Magnetite Nanostructures as Novel Strategies for Anti- Infectious Therapy. molecules , 19 (2014), 12710-12726.
7. Perelo, L. W. (2010). Review: In situ and bioremediation of organic pollutants in aquatic sediments . Journal of Hazardous Materials , 177 (2010), 81–89 .
[a] Universidad Tecnológica de Tula-Tepeji, Hidalgo, Programa de Química Industrial, miguelangel.ceron@uttt.edu.mx
[b] Universidad Tecnológica de Tula-Tepeji, Hidalgo, Programa de Ingeniería Ambiental, sonia.hernandez@uttt.edu.mx
[c] Universidad Tecnológica de Tula-Tepeji, Av. Universidad Tecnológica 1000, El Carmen, Tula de Allende, Hgo., C.P. 42830, México, Programa Educativo de Nanotecnología, victoralfredo.nolasco@uttt.edu.mx